
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эквивалент. Закон эквивалентов
|
|
|
|
Открыт немецким химиком И.Г. Рихтером. Эквивалентом вещества (или эквивалентной массой) называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях или реагирует с 1 эквивалентом любого другого вещества. Справедливо и другое, более простое определение. Эквивалент вещества - это такое его количество, которое содержит 1 грамм водорода, либо вступает в реакцию с 1 граммом водорода, замещает то же количество водорода в химических реакциях или реагирует с 1 эквивалентом любого другого вещества. Эквивалентным объёмом газа называется объём, занимаемый при данных условиях одним эквивалентом вещества.
Закон эквивалентов:
Вещества вступают друг с другом в реакции в количествах, пропорциональных их химическим эквивалентам. При этом массы взаимодействующих веществ А + В ® С + Д пропорциональны их эквивалентным массам
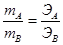
На основе закона эквивалентов можно вывести следующие формулы для вычисления эквивалентных масс сложных веществ.
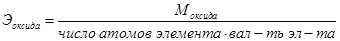
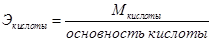
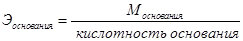
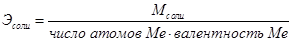
Закон кратных отношений (Д. Дальтон,1803 г)
При химическом взаимодействии происходит соединение атомов в молекулы и, таким образом, молекула содержит различные атомы в строго опредёленных, постоянных и целочисленных отношениях. На основании этих представлений Д. Дальтон (1766-1844) установил закон кратных отношений. Если два элемента образуют несколько химических соединений, то масса одного элемента, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Возьмём ряд оксидов азота
| N2O | NO | N2O3 | NO2 | N2O5 | |
| на одну массовую часть азота приходится кислорода | 0,57 | 1,14 | 1,71 | 2,28 | 2,85 |
| соотношение весовых долей |
|
|
|
Ещё один пример. Олово с хлором образует два соединения: SnCl2, белое твёрдое вещество и SnCl4 - безцветную жидкость, сильно дымящую во влажном воздухе. Первое из них содержит 37,2% хлора, а второе – 54% Найдём, какая масса хлора приходится на единицу массы в обоих соединениях. В первом - Ω(1) = m1/m2 = 37,2: 62,8 = 0,59; во втором – Ω(2) = m1/m2 = 54,0: 46,0 =1,18. Действительно, Ω(1)/Ω(2) = 0,59: 1,18 = 1:2. Таким образом получается, что в молекуле второго соединения число атомов хлора вдвое больше, чем в молекуле первого. Но вот сколько именно в каждом случае – сказать невозможно. Например, Дальтон считал, что молекула воды двухатомна, так как других соединений водорода и кислорода в то время не знали. Он также полагал, что молекулы простых веществ одноатомны: точного критерия химической формулы в те годы не существовало. Однако уже в то время было очевидно, что и закон постоянства состава, и закон кратных отношений, и закон эквивалентов могут работать только в рамках атомной теории.
Закон объёмных отношений (Гей-Люссак, 1808г.)
Объёмы реагирующих газов, образующих новое соединение, соотносятся между собой как небольшие целые числа.
Например, один объём кислорода реагирует точно с двумя объёмами водорода, и при этом образуется точно один объём водяного пара.
2Н2 + О2 = 2Н2О;
Далее логично было бы предположить, что объёмы различных газов при постоянных температуре и давлении пропорциональны количеству молекул, содержащихся в этих объёмах. Тогда молекула воды будет содержать один атом кислорода и два – водорода, аммиака – три атома водорода и один - азота и т.д. Благодаря открытию этого закона шкала атомных масс Дальтона была исправлена: кислород приобрёл атомную массу 16, азот –14 углерод – 12 и т.д. Но молекулы простых веществ по прежднему считали одноатомными, поэтому, соединение одного объёма водорода с одним объёмом хлора должно было бы дать один объём хлористого водорода, а на практике получалось два:
|
|
|
H2 + Cl2 = 2HCl;
Это противоречие попытался разрешить итальянский химик А.Авогадро, выдвинувший гипотезу о том, что в равных объёмах газов и паров содержится одинаковое количество частиц.
К закону Авогадро мы вернёмся после определения ряда необходимых нам фундаментальных понятий современной химии.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 670; Нарушение авторских прав?; Мы поможем в написании вашей работы!