
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория кристаллического поля
|
|
|
|
Химическая связь в координационных соединениях
Образование химической связи в координационных соединениях объясняется с использованием как упомянутых в предыдущей лекции методов валентных связей (МВС) и молекулярных орбиталей (ММО), так и специфического приближения - теории кристаллического поля (ТКП).
Теория кристаллического поля исходит из того, что природа лигандов и их расположение вокруг центрального иона (симметрия комплекса) уменьшают вырождение d-орбиталей и изменяют их энергию. Рассмотрим это на примере комплексного иона октаэдрической симметрии [ML6]n+, в котором центральный атом имеет электронную конфигурацию d1. Ион Mn+ расположен в центре октаэдра, сoвпадающем с началом прямоугольной системы координат, а лиганды - в вершинах октаэдра, через которые проходят оси координат (x, y, z). Орбитали dx²-y² и dz² совпадают с координатными осями, а остальные три (dxy, dxz, dyz) проходят вдоль биссектриc соответствующих координатных углов (рис. 9.5). B отсутствии лигандов все пять орбиталей были энергетически равноценны. Но с появлением лигандов в вершинах октаэдра электрон, находясь на орбиталях dx²-y² и dz², испытывает сильное отталкивание от отрицательно заряженных лигандов или от отрицательного конца полярной молекулы. Другие три орбитали попадают в области с минимальными значениями отрицательного потенциала, поэтому вероятность нахождения электрона на орбиталях dxy, dxz, dyz будет больше. Это соответствует тому, что под действием лигандов прежде энергетически равноценные d-орбитали разделились на две группы: орбитали dx²-y² и dz⊃2;(dγ)*), энергетически невыгодные для электрона, и орбитали dxy, dxz, dyz(dε)*) с меньшей энергией. Схема расщепления d-орбиталей октаэдрическим (тетраэдрическим) окружением показана на рис. 9.5. Разность между dε и dγ-уровнями обозначается через Δокт (Δтетр) и называется параметром расщепления *). *) В научной литературе орбитали обычно dγ и dε обозначают eg и t2g, а параметр расщепления 10Dq.
|
|
|
 1 1
|
| Рисунок 9.5 Диаграмма расщепления d-орбиталей в поле лигандов |
Из рис. 9.5 следует, что заселение любой dε-орбитали одним электроном приводит к уменьшению на 0,4Δокт энергии октаэдрического комплекса, т. е. стабилизирует его по сравнению со свободным (сферически симметричным) ионом, а заселение электроном любой из dγ-орбиталей этот комплекс дестабилизирует на 0,6?окт. В тетраэдрическом поле порядок расщепления d-орбиталей будет обратным, а потому энергия стабилизации на один электрон будет 0,6 Δтетр, а дестабилизации - 0,4 Δтетр. Величина понижения энергии координационного соединения в результате перераспределения d-электронов по dε- и dγ-орбиталям называется энергией стабилизации кристаллическим полем (ЭСКП). Эта энергия зависит от числа электронов на dε- и dγ-орбиталях и вычисляется по формулам:
ЭСКПокт = (0,4n - 0,6m) Δокт, ЭСКПтетр = (0,6n - 0,4m) Δтетр,
где n - число электронов на нижнем подуровне, m - число электронов на верхнем подуровне. Параметр расщепления в октаэдрическом поле больше, чем в тетраэдрическом, содержащем те же лиганды, и равен Δокт = 9/4 Δтетр Параметр расщепления Δ зависит от размеров центрального иона, его заряда, электронной конфигурации и от природы лиганда (табл. 9.1). Экспериментально его определяют по спектрам поглощения комплексных соединений. Возбуждение электрона с нижнего уровня на верхний сопровождается поглощением энергии и появлением в спектре полосы, максимум которой соответствует энергии расщепления Δ. Значение Δ обычно выражают в волновых числах ν = 1/λ см-1 *). Большинство значений ν лежит в пределах от 10000 до 30000 см-1. *) 1 см-1 соответствует энергии E = hνc = 6,26·10-34·3·1010·1 = 2,0·10-23 Дж = 11,96 Дж·моль-1 = 1,25·10-4 эВ. В ряду 3d-, 4d-, 5d-элементов при прочих равных условиях ν увеличивается от периода к периоду на 30-35 %. Например, для
[Co(NH3)6]3+ ν = 23000 см-1, для [Rh(NH3)6]3+ ν = 34000 см-1, для [Ir(NH3)6]3+ ν = 41000 см-1. Величина ν возрастает при переходе от комплексов двухрядных ионов 3d-элементов к трёхрядным. Так для [Fe(H2O)6]2+ и [Fe(H2O)6]3+ значения ν равны соответственно 10400 см-1 и 13700 см-1. Из спектроскопических измерений была найдена последовательность расположения лигандов по возрастанию их влияния на величину расщепления?, называемая спектрохимическим рядом:
|
|
|
| ||||||
| Таблица 9.1 Спектрохимический ряд лигандов |
В октаэдрических комплексах, образуемых ионами с электронными конфигурациями d4, d5, d6, d7, возможно различное размещение электронов - либо высоко-, либо низкоспиновое в зависимости от параметра расщепления? и энергии спаривания P. Последняя определяется как разность энергий межэлектронного взаимодействия низкоспиновой (НС) и высокоспиновой (ВС) конфигураций, деленная на число спаривающихся электронов. Очевидно, что низкоспиновое состояние реализуется тогда, когда P < Δ, а высокоспиновое - когда P > Δ.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 9.2 |
В рамках ТКП высокоспиновый комплекс  с электронной конфигурацией
с электронной конфигурацией 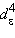
 будет менее устойчив (ЭСКП = 0,4?), чем низкоспиновый
будет менее устойчив (ЭСКП = 0,4?), чем низкоспиновый  (электронная конфигурация
(электронная конфигурация  ЭСКП = 2,4
ЭСКП = 2,4  ). Распределение электронов между нижним (dγ) и верхним (dε) уровнями в тетраэдрических комплексах также зависит от соотношения? и P, но поскольку?тетр <?окт, тетраэдрические комплексы обычно остаются высокоспиновыми. В отличие от метода валентных связей, ТКП, основываясь на электронной конфигурации центрального атома, положении лигандов в спектрохимическом ряду и симметрии комплекса, позволяет не только объяснять, но и предсказывать магнитные и спектроскопические свойства комплексов. С физической точки зрения ТКП является весьма приближенной, поскольку учитывает только электростатическое взаимодействие между комплексообразователем и лигандами. ТКП не дает объяснения устойчивости комплексов с электронными конфигурациями центрального атома d0 и d10, однако существование подобных комплексов легко объяснимо с позиций метода молекулярных орбиталей.
). Распределение электронов между нижним (dγ) и верхним (dε) уровнями в тетраэдрических комплексах также зависит от соотношения? и P, но поскольку?тетр <?окт, тетраэдрические комплексы обычно остаются высокоспиновыми. В отличие от метода валентных связей, ТКП, основываясь на электронной конфигурации центрального атома, положении лигандов в спектрохимическом ряду и симметрии комплекса, позволяет не только объяснять, но и предсказывать магнитные и спектроскопические свойства комплексов. С физической точки зрения ТКП является весьма приближенной, поскольку учитывает только электростатическое взаимодействие между комплексообразователем и лигандами. ТКП не дает объяснения устойчивости комплексов с электронными конфигурациями центрального атома d0 и d10, однако существование подобных комплексов легко объяснимо с позиций метода молекулярных орбиталей.
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 291; Нарушение авторских прав?; Мы поможем в написании вашей работы!





