
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости
Амфотерные электролиты
Существует группа соединений, в молекулах которых содержатся кислотные и основные группы. Такие соединения называют амфотерными электролитами, или амфолитами. Классический пример амфолитов – аминокислоты жирного ряда NH2RCOOH. В водном растворе аминокислот в результате внутренней ионизации образуются цвиттер-ионы (двойные или биполярные ионы, амфиионы):
NH2RCOOH Û +NH3RCOO–
При добавлении сильной кислоты в раствор аминокислоты происходит реакция
+NH3RCOO– + Н+ Û +NH3RCOOН,
а при добавлении сильной щелочи – реакция
+NH3RCOO– + ОН– Û NH2RCOO– + Н2О
Таким образом, основные свойства аминокислоты обусловлены группой – СОО– , а кислотные – группой – NH3+ .
При растворении твердых веществ в воде может быть достигнуто состояние насыщения раствора, при котором для данной температуры растворение вещества прекратится, при этом твердая фаза будет находиться в равновесии с растворенным веществом. Если вещество (соль M n A m) является электролитом, то в растворе установится равновесие
M n A m (тв.) Û n Mz+ + m Az–.
Константа диссоциации соли
Кд = 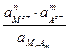 ;
;
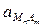 при данной Т является величиной постоянной.
при данной Т является величиной постоянной.
Кд × 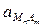 = ПР =
= ПР = 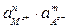 .
.
Таким образом, в насыщенном растворе соли произведение активностей ее ионов есть величина постоянная, она называется произведением растворимости.
Если соль малорастворима и ее раствор разбавлен, то в выражении для ПР активности можно заменить концентрациями.
Из уравнения для ПР следует, что при добавлении к раствору малорастворимой соли хорошо растворимого соединения, имеющего общий ион с малорастворимой солью, растворимость соли будет уменьшаться. Кроме того, добавление посторонней соли к раствору увеличивает ионную силу этого раствора и уменьшает коэффициент активности той соли, которая находилась в растворе до введения посторонней добавки.
Величины ПР имеют большое практическое значение в химической технологии и в аналитической химии, так как они определяют условия, при которых должно происходить растворение солей или выделение их из растворов.
ПР наиболее точно можно измерить методом ЭДС; часто также пользуются определением растворимости по электропроводности насыщенных растворов, однако этот метод применим только к растворам чистой соли.
Лекция 53
|
|
Дата добавления: 2014-01-07; Просмотров: 308; Нарушение авторских прав?; Мы поможем в написании вашей работы!