
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные, или редокси-электроды
|
|
|
|
Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ, и в этом смысле все электроды представляют собой редокси-системы. Однако термин окислительно-восстановительные, или редокси-электроды, употребляется обычно в тех случаях, когда в реакции не участвуют непосредственно металлы или газы. Металл в редокси-электроде, обмениваясь электронами с участниками окислительно-восстановительной реакции, принимает потенциал, отвечающий установившемуся редокси-равновесию. К металлическому проводнику предъявляются здесь те же требования, что и в случае газовых электродов.
Следует различать простые и сложные редокси-электроды. В первом случае электродная реакция сводится к перемене валентности ионов без изменения их состава, например
Fe3+ + e = Fe2+,
Tl3+ + 2 e = Tl+,
MnO4– + e = MnO42–,
Fe (CN)63– + e = Fe (CN)64–.
Если обозначить окисленные ионы Ox, а восстановленные Red, то все написанные выше реакции можно выразить одним общим уравнением
Ox + ne = Red.
Простой редокси-электрод записывается в виде схемы
Red, Ox êPt,
а его потенциал дается уравнением
ERed,Ox = EoRed,Ox + 2,303 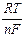 lg
lg 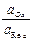 .
.
Как видно, потенциал простого редокси-электрода определяется отношением активностей ионов в двух различных степенях окисления. Если элемент образует ионы нескольких валентностей, то ему будет отвечать столько редокси-электродов, сколько можно получить попарных сочетаний (три валентности - три различных редокси-электрода).
Потенциалы простых редокси-электродов можно легко связать с потенциалами соответствующих электродов первого рода. Пусть, например, металл М способен существовать в растворе в виде ионов высшей валентности М h и низшей валентности M n. Для него возможны два электрода первого рода M h êM и M n êM и один редокси-электрод M n, M h êM, стандартные потенциалы которых соответственно равны 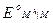 ,
,  и
и 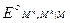 . Связь между этими величинами можно найти, проведя мысленно процесс электрохимического растворения металла М с получением ионов высшей валентности M h либо непосредственно, либо через промежуточное образование ионов низшей валентности M n. Предполагается, что процесс растворения протекает обратимо и изотермически в бесконечно большом объеме раствора, в котором активности ионов каждого сорта равны 1. Этот процесс можно представить в виде следующего простого цикла:
. Связь между этими величинами можно найти, проведя мысленно процесс электрохимического растворения металла М с получением ионов высшей валентности M h либо непосредственно, либо через промежуточное образование ионов низшей валентности M n. Предполагается, что процесс растворения протекает обратимо и изотермически в бесконечно большом объеме раствора, в котором активности ионов каждого сорта равны 1. Этот процесс можно представить в виде следующего простого цикла:
|
|
|
- h FEo h
M ----® M h
- n FEo n æ ä - (h - n)FEo n , h
M n
Из цикла следует
h Eo h = n Eo n + (h - n)Eo n , h .
Это уравнение известно как правило Лютера; по нему можно рассчитать стандартный потенциал любого из трех электродов, если известны значения стандартных потенциалов двух других электродов. Уравнение применяется в тех случаях, когда непосредственное определение одного из потенциалов или затруднительно, или невозможно. Так, например, потенциал электрода первого рода Fe3+ | Fe, измерить который непосредственно не удается из-за неустойчивости в этих условиях ионов Fe3+, можно найти из доступных прямому измерению стандартных потенциалов электрода первого рода Fe2+ | Fe и простого редокси-электрода Fe2+, Fe3+| Fe:
 =
= 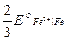 +
+  .
.
В сложных редокси-электродах реакция протекает с изменением валентности реагирующих частиц и их состава. В реакциях такого рода участвуют обычно ионы водорода и молекулы воды; участие молекул воды не сказывается на характере уравнений для электродного потенциала, так как активность воды в ходе реакции (за исключением очень концентрированных растворов) остается постоянной. Схему сложного редокси-электрода можно записать следующим образом:
Red, Ox, H+ | Pt
Таким образом, потенциал сложного редокси-электрода является функцией не только активностей окисленных и восстановленных частиц, но и активности водородных ионов. Например, для системы MnO4– - Mn2+, в которой протекает электродная реакция
|
|
|
MnO4– + 8H+ + 5 e = Mn2+ + 4H2O,
потенциал электрода передается уравнением
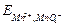 =
= 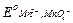 +
+  ln
ln  =
=
= 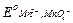 + 2,303
+ 2,303  lg
lg 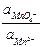 + 2,303
+ 2,303 
 lg
lg  .
.
Сложные редокси-электроды можно использовать как индикаторные электроды при измерении рН. Для этой цели часто применяют электрод, обратимый по отношению к системе хинон-гидрохинон. Для системы хинон-гидрохинон (х, гх) с реакцией
С6Н4О2 + 2Н+ + 2 е = С6Н4(ОН)2
потенциалу электрода отвечает уравнение
Eх, гх = Eох, гх + 2,303 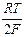 lg
lg 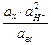 =
=
= Eох, гх + 2,303 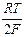 lg
lg  + 2,303
+ 2,303  lg
lg  .
.
В раствор, рН которого хотят измерить, вводят эквимолярную смесь хинона и гидрохинона. Если считать, что отношение концентраций равно отношению активностей
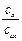 =
=  = 1,
= 1,
то уравнение упрощается до
Eх, гх = Eох, гх + 2,303  lg
lg  = Eох, гх - 2,303
= Eох, гх - 2,303  рН,
рН,
и потенциал такого электрода, обычно называемого хингидронным, будет определяться непосредственно значением рН раствора. При 25оС Eох, гх = 0,6992 В; температурная зависимость Eох, гх хорошо изучена. Хингидронный электрод легко приготовляется и удобен в работе. Хингидронным электродом нельзя пользоваться в щелочных растворах (гидрохинон - слабая кислота, в щелочной среде он сильно диссоциирует, и концентрация его в насыщенном растворе не является постоянной), а также в присутствии сильных окислителей или восстановителей.
Лекция 57
Классификация электрохимических цепей. Физические цепи. Концентрационные цепи. Химические цепи. Аккумуляторы
Учитывая природу электродной реакции, можно классифицировать не только различные типы электродов, но и их комбинации. Электрохимические цепи обычно классифицируют по двум признакам: по источнику электрической энергии (физические, концентрационные, химические) и по наличию или отсутствию в цепи границы двух различных растворов (цепи с переносом и без переноса).
1. Система составлена из двух химически одинаковых электродов, на которых совершается одна и та же электродная реакция. ЭДС таких систем была бы равна нулю, если бы физические свойства электродов, а следовательно, и их стандартные потенциалы были одинаковыми. Электрохимические системы, в которых электроды отличаются только физическими свойствами, называются физическими цепями. Как правило, один из двух электродов физической цепи находится в более устойчивом, а другой - в менее устойчивом при данных условиях состоянии. Источником электрической энергии в физических цепях служит свободная энергия перехода электрода из менее устойчивого в более устойчивое состояние.
|
|
|
2. Два электрода совпадают по своим физическим свойствам, качественному химическому составу и природе электродной реакции. Они отличаются лишь тем, что активность одного или нескольких участников реакции на электродах неодинакова. Электрохимические цепи, в которых электроды отличаются только активностью (концентрацией) участников электродной реакции, называются концентрационными цепями. Источником электрической энергии в концентрационных цепях служит энергия переноса вещества от большей активности к меньшей.
3. Два электрода могут отличаться и по химическим, и по физическим свойствам. Такие цепи называются химическими. В химических цепях источником электрической энергии служат протекающие в них химические реакции.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 820; Нарушение авторских прав?; Мы поможем в написании вашей работы!