
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фотохимия
|
|
|
|
.
Для бинарной смеси газов сечение соударений будет
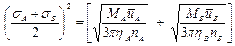 .
.
Для химической кинетики достаточно точно можно оценить величину сечения соударений, считая, что в жидкости или в твердом теле происходит плотная упаковка молекул; молекулы считаются твердыми сферами. Объем, занимаемый 1 моль (молярный объем), равен M/ d, где d – плотность вещества, г/см3 . При плотной упаковке шарик радиусом r занимает объем 8 r 3 / . Следовательно,
. Следовательно,
 ,
,
 .
.
Для взаимодействия одинаковых и неодинаковых молекул константа скорости выражается уравнениями
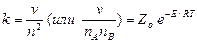 ,
,
где k имеет размерность см3 /(молекула×с);
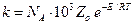 ,
,
где k имеет размерность л /(моль×с).
Zo – фактор соударений (частоту столкновений) – рассчитывают по формуле

при столкновении одноименных молекул и
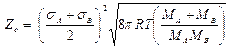
при столкновении разноименных молекул. Число столкновений ZAA и ZAВ имеет размерность см–3×с–1, Zo имеет размерность см3 /(молекула×с).
Окончательное выражение для константы скорости бимолекулярной реакции:
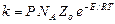 ,
,
где Р – стерический фактор (стерический множитель). Это уравнение иногда называют уравнением Траутца – Льюиса.
Предэкспоненциальный множитель в уравнении Аррениуса k = C e – E /RT, согласно теории бинарных столкновений, выражается так:
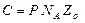 .
.
Согласно теории активного комплекса (переходного состояния) константу скорости бимолекулярной реакции определяют по уравнению Эйринга:
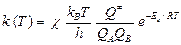 ,
,
где c – трансмиссионный коэффициент (коэффициент прохождения), c £ 1; k B = 1,38×10–23 Дж/К – постоянная Больцмана; h = 6,63×10–34 Дж×с – постоянная Планка; Q ¹ – молекулярная статистическая сумма (полная сумма по состояниям) активированного комплекса; Q А и Q В – полные суммы по состояниям реагентов; Е о – энергия активации при абсолютном нуле.
|
|
|
Термодинамическая форма уравнения Эйринга имеет вид
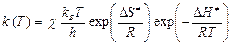 ,
,
где D S ¹ и D Н ¹ – энтропия и энтальпия активации.
Основные законы фотохимии:
1. Закон Гротгуса – Дрейпера: химически активны лишь те лучи, которые поглощаются реакционной смесью. Этот закон очевиден и не имеет исключений. Закон Гротгуса – Дрейпера непосредственно связывает химическое действие света с его поглощением веществом.
2. Ламберт (1760) установил, что ослабление интенсивности dI света, прошедшего через слой толщиной d l, прямо пропорционально толщине слоя и интенсивности падающего света I, а Бер (1853) показал, что поглощение тонким слоем прямо пропорционально числу частиц (молекул) или их концентрации в слое. Объединенный закон Ламберта – Бера можно записать в форме
I = Io e – knl ,
Io - интенсивность светового потока до прохождения поглощающего слоя;
I - то же после поглощения в слое толщиной l;
n - число поглощающих свет молекул в 1 см3;
k - множитель пропорциональности, называемый молекулярным коэффициентом поглощения.
3. Закон Вант-Гоффа (1904): количество химически измененного вещества прямо пропорционально количеству поглощенной веществом световой энергии
- 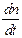 = K Io (1 - e – knl ),
= K Io (1 - e – knl ),
К - множитель пропорциональности.
4. Закон фотохимической эквивалентности Штарка – Эйнштейна (1912): каждому поглощенному кванту излучения hn соответствует одна измененная молекула. Закон Штарка – Эйнштейна – основной закон фотохимии.
Количество энергии, необходимое для фотопревращения одного моля вещества при данной длине волны, равно NA hn = 6,02×1023 hn и носит название эйнштейн. Числовое значение одного эйнштейна зависит от частоты колебаний.
Опыт показывает, что во многих случаях число фотохимически прореагировавших молекул не равно числу поглощенных квантов. Поэтому для характеристики фотохимических реакций было введено понятие квантового выхода g. Квантовым выходом называется отношение числа прореагировавших молекул к числу поглощенных квантов:
|
|
|
g = 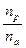 =
= 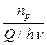 ,
,
где n p - число прореагировавших молекул.
Скорость химической реакции
- 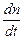 =
= 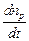 = g
= g 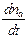 = g
= g 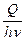 ,
,
- 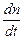 = g
= g 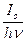 (1 - e – knl ).
(1 - e – knl ).
Это наиболее общее выражение для скорости фотохимической реакции, объединяющее все законы фотохимии и дающее теоретическую интерпретацию коэффициенту пропорциональности в уравнении Вант-Гоффа.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 479; Нарушение авторских прав?; Мы поможем в написании вашей работы!