
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм процесса растворения
Растворимость твердых веществ в жидкостях
Взаимная растворимость жидкостей
Растворимость газов в жидкостях
Способы выражения концентрации раствора (самостоятельно)
Механизм процесса растворения
Растворы и их классификация (самостоятельно)
Растворы
СЛАЙДЫ К ЛЕКЦИИ
Время — 2часа.
НА САМОПОДГОТОВКУ ПО ТЕМЕ 7.1 ДИСЦИПЛИНЫ
Разработал
Доцент, к.т.н. Г.В. Бушнев
Приложение 1.
ЗАДАНИЕ
«ПОЖАРНАЯ БЕЗОПАСНОСТЬ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ»
Изучить типовые технические решения по предотвращению самопроизвольного возникновения горения при взаимодействии веществ с кислородом воздуха, с водой и влагой воздуха, друг с другом, а также вследствие их саморазложения.
Литература
1.С. Киселев Физические модели горения в системе пожарной безопасности. Под общей редакцией В.С.Артамонова. – СПб.: Изд-во Политехн. ун-та, 2009.- 348 с.
ПРИЛОЖЕНИЕ 2.
(тема 7.1)
Процесс растворения нельзя рассматривать как простое механическое распределение одного вещества в другом. При растворении происходит физико-химические взаимодействия растворенного вещества с молекулами растворителя.
Процесс растворения часто сопровождается поглощением или выделением тепла. Это свидетельствует о том, что частицы растворенного вещества образуют с молекулами растворителя химические соединения. Эти соединения называют сольватами, а процесс их образования сольватацией. В случае когда растворитель Н2О гидратами и гидратацией.
Как уже говорилось процесс растворения является сложным физико-химическим процессом, в котором проявляется взаимодействия между частицами различной химической природы.
На процессе растворения оказывают большое влияние полярность молекул растворителя и растворенного вещества.
Полярность растворителя характеризуется его диэлектрической постоянной e, чем более полярен растворитель тем выше e.
Процесс растворения заключается в следующем (рис.1, 2 СЛ. 1, 2):
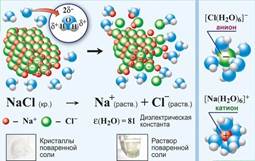
Рис. 1. Растворение веществ с ионной связью в воде.
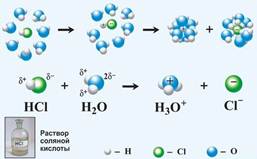
Рис. 2. Растворение веществ с ковалентной связью в воде.
Процесс растворения заключается в следующем (рис.1): полярные молекулы растворителя своими отрицательными полюсами подходят к положительным атомам кристаллической решетки, а положительные к отрицательным. И образуя таким образом сольватная связь оказывается более прочной чем ионная в кристалле. В результате теплового движения она полностью рвется и происходит полная сольватация тех частиц, которые оказываются в глубине раствора.
Следует отметить, что процесс гидратации сопровождается выделением тепла, называемый тепловой сольватации (гидратации).
4. СЛ. 3(0) Растворимость газов в жидкостях
Газы при соприкосновении с жидкостью способны растворяться в ней. Растворимость газов зависит от их природы, характера жидкости, а также от температуры и давления. Например, растворимость азота 0,017 объема в одном объеме воды, а аммиака 748,80.
Высокая растворимость аммиака объясняется их химическим взаимодействием с водой или диссоциацией на ионы. Растворимость одних и тех же газов в различных растворителях разная.
Газы, молекулы которых неполярные, растворяются, как правило, лучше в неполярных растворителях. И, наоборот, в полярных растворителях лучше растворяются газы, молекулы которых полярные. растворимость аммиака выше всего в воде как в сильно полярной жидкости, в толуоле же, как в неполярном растворителё, растворимость его ничтожна.
На растворимость газов большое влияние оказывают давление и температура. Зависимость растворимости газов от давления выражает СЛ. 3(1) законом Генри: растворимость данного газа в жидкости прямо пропорциональна его давлению над жидкостью.
C=KP
где С — нонцентрация газа в жидкости, Р — давление газа над раствором, К — коэффициент пропорциональности, зависящий от природы газа.
Из закона Генри вытекают следующие важные следствия:
(2) 1. Поскольку давление газа Р пропорционально концентрации его в газовой фазе, то:
Сж=СгК или Сж/Сг=К
Иными словами, отношение концентрации газа, растворенного в жидкости, к концентрации его над раствором при постоянной температуре есть величина постоянная.
(3) 2. Объем растворенного газа не зависит от внешнего давления, поскольку при увеличении давления в одинаковое число раз, возрастает как концентрация растворенного газа, так и концентрация газа над раствором.
Таким образом, растворимость газа в жидкости прямо пропорциональна его парциальному давлению. Понижение парциального давления приводит к уменьшению растворимости газа.
Закон Генри справедлив только для разбавленных растворов и при малых давлениях, т. е. когда газы подчиняются законам идеальных газов.
Газы, вступающие во взаимодействии при растворении во взаимодействие с растворителем (НС1, NН3 и др.), закону Генри не подчиняются. При растворении смеси газов каждый йз нихрастворятся в количестве, пропорциональном его парциальному давлению.
Растворимость газов в сильной степени зависит от температуры.
Количественная зависимость между растворимостью газа и температурой определяется СЛ. СЛ.4(1) уравнением Клайперона – Клаузиуса:

где N1 и N2 – растворимости при температурах Т1 и Т2, a – теплота, выделяёмая при растворении одного моля газа, R – универсальная газовая постоянная.
Растворимость газов зависит и от наличия посторонних электролитов в растворе, Присутствие электролитов снижает растворимость газов в жидкостях. Зависимость растворимости газов от присутствия электролитов впервые была установлена СЛ. 4(2) И. М. Сеченовым:
N0/N=KC
Где N0 и N — растворимость газа соответственно в чистой воде и в растворе соли, К – коэффициент зависящий от природы газа, электролита и температуры, С – концентрация электролита.
|
|
Дата добавления: 2014-01-07; Просмотров: 6741; Нарушение авторских прав?; Мы поможем в написании вашей работы!