
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаимная растворимость жидкостей
В зависимости от природы жидкости могут смешиваться друг
другом в различных соотношениях:
1) смешиваются друг с другом в любых соотношениях с образованием совершенно однородного раствора (ввода и этиловый спирт);
2) обладают ограниченной растворимостью друг в друге (вода и эфир);
3) практически не растворимы друг в друге (вода и бензол).
Рассмотрим случай ограниченной растворимости на примере системы анилин — вода. Если в пробирку налить немного анилина, прибавить примерно такое же количество воды и энергично встряхивать ее, пока не получится эмульсия, то после непродолжительного
отстаивания жидкость в пробирке образует два слоя: верхний – насыщенный раствор анилина в воде, нижний – насыщенный раствор воды в анилине.
Характерно, что для каждой температуры оба раствора имеют строго
определенный равновесный состав, не изменяющийся от прибавления дополнительных количеств воды или анилина. Повышение температуры ведет обычно к увеличению взаимной растворимости и может привести к неограниченному взаимному растворению. Температура, при которой растворимость переходит в неограниченную, называется критической температурой растворения.
Зависимость состава обоих растворов от температуры удобно изображать в виде диаграммы растворимости. На рис. 3 СЛ. 5 приведена диаграмма для системы вода – анилин.
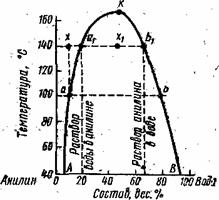
Рис. 3. Диаграмма взаимной растворимости воды и анилина.
Подобные кривые называются кривыми расслоения. На рис. 3 АК – кривая растворимости воды в анилине; ВК — кривая растворимости анилина в воде. Обе кривые сходятся в точке К, соответствующей критической температуре растворения. Любые точки, лежащие вне кривой АКВ, отвечают гомогенной системе, ненасыщенным растворам компонентов. Точки, лежащие внутри фигуры АКВА, соответствуют системе, состоящей из двух растворов (двух слоев), составы которых определяются точками пересечения соответствующей изотермы с кривой АКВ.
Если взять смесь при температуре 140°С состава х, то она будет однородной. При охлаждении ее до 100°С она расслаивается, и составы образовавшихся насыщенных растворов будут на диаграмме отвечать точкам А и В. Если при 140° С взять смесь состава х1, то она, как видно из диаграммы также расслаивается на насыщенные растворы, составы которых соответствуют точкам А1 и В1.
Взаимная растворимость жидкостей в значительной степени зависит от присутствия третьего компонента, который может оказывать существенное влияние на критическую температуру растворителя. например, тот же самый анилин может неограниченно смешиваться с водой при всех температурах, если в растворе присутствует достаточное количество LiI. Объясняется это тем, что LiI в одинаковой мере хорошо растворим как в анилине, так и в воде. Если же третий компонентхорошо растворим только в одной из жидкостей, взаимная растворимость обеих жидкостей в присутствии этого компонента уменьшается, а следовательно, увеличивается критическая температура растворения.
Иногда введением третьего компонента можно добиться расслоения ранее однородного раствора на два слоя. Например, для выделения этилового спирта из его водного раствора поступают следующим образом. К водному раствору спирта прибавляют K2CO3 и энергично встряхивают. После отстаивания раствор разделяется на два несмешивающихся слоя. Один из слоев состоит из почти безводного этилового спирта, а другой— из водного раствора K2CO3.
|
|
Дата добавления: 2014-01-07; Просмотров: 1257; Нарушение авторских прав?; Мы поможем в написании вашей работы!