
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 1. 7
Молекулярная физика. Молекулярно-кинетическая теория (МКТ). Основные положения МКТ. Молекулярная физика представляет собой раздел физики, изучающий строение и свойства вещества, исходя из молекулярно-кинетических представлений. Совокупность этих представлений составляет основу МКТ. Согласно представлениям МКТ, любое тело – твердое, жидкое или газообразное – состоит из большого количества очень малых обособленных частиц – молекул и атомов. Эти молекулы находятся в состоянии непрерывного хаотического движения, интенсивность которого определяется температурой тела.
Непосредственным доказательством существования хаотического движения молекул служит броуновское движение. Это явление заключается в том, что малые (видимые только под микроскопом) частицы, взвешенные в жидкости (или газе), всегда находятся в состоянии непрерывного хаотического движения. Это движение происходит под влиянием беспорядочных ударов молекул о броуновскую частицу.
Статистический и термодинамический методы исследования. Число атомов и молекул в любом теле очень велико. Например, в 1 м3 воздуха при нормальных условиях содержится  молекул, а в жидких и твердых телах
молекул, а в жидких и твердых телах  молекул. Размеры же молекул находятся в пределах
молекул. Размеры же молекул находятся в пределах  м.
м.
Представление тел с позиций МКТ приводит нас к одному из базовых понятий механики – понятию «механической системы». Как мы уже говорили, определить состояние системы значит определить состояние движения составных частей этой системы, т.е. молекул – определить координаты и скорость каждой молекулы и указать направления и величины действующих на нее сил. Иначе говоря, необходимо для каждой молекулы записать уравнение движения и задать начальные и граничные условия.
Однако из приведенных выше данных ясно, что даже при рассмотрении малых объемов вещества количество заключенных в этом объеме молекул огромно. В результате записать для каждой молекулы уравнение движения и затем решить (даже с привлечением современных многопроцессорных ЭВМ) такую систему ДУ ввиду чрезмерно большого числа уравнений практически не представляется возможным.
В связи с этим свойства таких макроскопических систем изучаются двумя взаимно дополняющими друг друга методами: статистическим и термодинамическим. Статистический метод основан на использовании теории вероятности и определенных моделей строения изучаемых систем. С помощью данного метода, например, могут быть установлены значения таких важных параметров, характеризующих макроскопическую систему в целом, как средняя  , среднеквадратичная
, среднеквадратичная  и наиболее вероятная
и наиболее вероятная 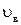 скорости молекул, установлена связь между этими параметрами и средней энергией молекулы
скорости молекул, установлена связь между этими параметрами и средней энергией молекулы 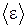 , а также давлением, оказываемы молекулами на стенки сосуда, в котором они находятся. Термодинамический метод – метод, в котором, в отличие от статистического метода, не рассматривается внутреннее строение изучаемых тел и характер движения отдельных их частиц. Термодинамический метод основан на анализе условий и количественных соотношений при различных превращениях энергии, происходящих в системе. Данный метод основан на трех, установленных опытным путем законах, называемых началами термодинамики.
, а также давлением, оказываемы молекулами на стенки сосуда, в котором они находятся. Термодинамический метод – метод, в котором, в отличие от статистического метода, не рассматривается внутреннее строение изучаемых тел и характер движения отдельных их частиц. Термодинамический метод основан на анализе условий и количественных соотношений при различных превращениях энергии, происходящих в системе. Данный метод основан на трех, установленных опытным путем законах, называемых началами термодинамики.
Термодинамические системы. Открытые, закрытые, изолированные и замкнутые системы. Термодинамические параметры системы (параметры состояния). Макроскопическая система, рассматриваемая методами термодинамики, называется термодинамической системой. Термодинамическая система, которая может обмениваться веществом с внешней средой, называется открытой. Соответственно система, не имеющая возможности обмениваться веществом с внешней средой, называется закрытой. Термодинамическая система называется изолированной, если она не может обмениваться с внешней средой ни энергией, ни веществом. Термодинамическая система называется замкнутой, если она изолирована в механическом отношении, т.е. не способна обмениваться с внешней средой энергией посредством совершения работы (например, сосуд постоянного объема).
Термодинамическими параметрами называются физические величины, характеризующие состояние термодинамической системы. К таким параметрам относятся, например, давление  , объем
, объем  и температура
и температура  .
.
Равновесное и неравновесное состояние системы. Состояние системы, при котором все параметры состояния имеют строго определенные значения, не изменяющиеся со временем при неизменных внешних условиях, называется равновесным. Если хотя бы один из параметров состояния изменяется во времени, то такое состояние называется неравновесным.
Термодинамический процесс. Термодинамическая диаграмма. Переход системы из состояния в другое, сопровождающийся изменением значений термодинамических параметров, называется термодинамическим процессом. Отметим, что всякая система, находившаяся первоначально в неравновесном состоянии, будучи предоставленной самой себе постепенно приходит в равновесное состояние. Такой процесс называется процессом релаксации. Соответственно, время необходимое для того, чтобы система оказалась в равновесном состоянии, называется временем релаксации.
Всякий процесс, строго говоря, представляет собой последовательную смену одного неравновесного состояния другим. Однако, если изменение состояния системы происходит достаточно плавно, то в каждый конкретный момент времени значения параметров состояния в различных точках занимаемого системой объема лишь незначительно отличаются от некоторых средних по этому объему величин. В таком случае рассматриваемый процесс можно представить как последовательность непрерывно сменяющих друг друга равновесных процессов, при этом говорят, что рассматриваемый процесс является квазистационарным или равновесным.
Равновесный процесс может быть изображен в виде диаграммы состояния, представляющей собой график зависимости одного параметра состояния термодинамической системы от другого. В качестве примера на рис.  1 изображена так называемая
1 изображена так называемая 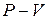 - диаграмма.
- диаграмма.
Если какой либо процесс может быть осуществлен как в прямом, так и в обратном направлении, причем система будет проходить при этом одну и туже последовательность состояний, то такой процесс называется обратимым. Отметим здесь, что все равновесные процессы являются обратимыми. Если какой либо процесс, заканчивается тем, что система приходит в исходное состояние, то такой процесс называется круговым процессом, или циклом. На диаграмме состояния такому процессу соответствует замкнутая кривая.
Идеальный газ. Уравнение состояния идеального газа (уравнение Капейрона – Менделеева). Газ, молекулы которого имеют пренебрежимо малые размеры и не взаимодействуют друг с другом, называется идеальным. Термодинамическое состояние заданной массы газа определяется значениями трех параметров состояния: давления, объема и температуры. Эта связь может быть задана в виде функции 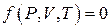 . Такое уравнение, устанавливающее связь между различными параметрами состояния системы называется уравнением состояния.
. Такое уравнение, устанавливающее связь между различными параметрами состояния системы называется уравнением состояния.
При достаточном разряжении, когда плотность газа мала, реальные газы близки по своим свойствам к идеальным, а некоторые газы, такие как гелий и водород, мало отличаются от идеального газа даже при нормальных условиях, т.е. при атмосферном давлении и комнатной температуре. На практике во многих случаях можно пренебречь отличием свойств от идеального газа и для воздуха.
Опытным путем было установлено, что при небольших плотностях газы хорошо подчиняются уравнению состояния следующего вида:
 . (1)
. (1)
Итальянским физиком Авогадро в 1811 была выдвинута гипотеза, согласно которой «одинаковые объемы различных газов при одинаковых давлении и температуре содержат одно и тоже число молекул». Гипотеза в дальнейшем получила практическое подтверждение и в настоящее время носит название закона Авогадро. Перепишем (1) для одного моля газа, получим
 . (2)
. (2)
Входящая в (2) постоянная  Дж/(моль·К) называется универсальной газовой постоянной. Перепишем (2) для произвольного количества вещества
Дж/(моль·К) называется универсальной газовой постоянной. Перепишем (2) для произвольного количества вещества  , получим
, получим
 , (3)
, (3)
где  и
и  - масса и молярная масса (масса одного моля) газа соответственно.
- масса и молярная масса (масса одного моля) газа соответственно.
Уравнение (3) можно записать в виде
 , (4)
, (4)
где  моль-1 – число Авогадро,
моль-1 – число Авогадро,  - масса молекулы. Отсюда получаем, что
- масса молекулы. Отсюда получаем, что
 , (5)
, (5)
где 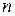 - концентрация молекул газа,
- концентрация молекул газа,  (Дж/К) – постоянная Больцмана.
(Дж/К) – постоянная Больцмана.
Соотношения (3) и (5) представляют собой различные формы записи уравнения состояния идеального газа.
Основное уравнение МКТ идеальных газов. Получим выражение для давления газа, исходя из представлений МКТ идеальных газов. Поскольку мы сейчас говорим о давлении, как о термодинамическом параметре, связанном с другими параметрами уравнением состояния, то рассматриваемое состояние системы следует считать равновесным. Равновесное состояние газа характеризуется в частности тем, что движение его молекул носит хаотический характер, при котором нет какого-либо выделенного преимущественного направления движения. Таким образом, все направления движения следует считать равновероятными. Рассмотрим с учетом сказанного некоторый объем газа. Предположим, что в этом объеме заключено N молекул. Предположим для простоты, что молекулы газа движутся только вдоль трех взаимно перпендикулярных направлений, т.е. вдоль осей ОХ, ОY и OZ. В виду равновероятности этих процессов очевидно, что вдоль каждой оси движутся в среднем  молекул. Вдоль каждой оси молекулы могут двигаться в одном из двух равновероятных направлений: по направлению оси и против направления оси. Таким образом, в строго заданном направлении (например, по направлению оси ОХ) движутся молекулы в количестве
молекул. Вдоль каждой оси молекулы могут двигаться в одном из двух равновероятных направлений: по направлению оси и против направления оси. Таким образом, в строго заданном направлении (например, по направлению оси ОХ) движутся молекулы в количестве  штук. Рассчитаем количество молекул, движущихся в данном направлении и претерпевающих за время
штук. Рассчитаем количество молекул, движущихся в данном направлении и претерпевающих за время  соударение со участком стенки сосуда площадью
соударение со участком стенки сосуда площадью  , перпендикулярной этому направлению. Предположим, что скорости молекул одинаковы и равны
, перпендикулярной этому направлению. Предположим, что скорости молекул одинаковы и равны  . В таком случае поверхности
. В таком случае поверхности  достигнут молекулы, заключенные в цилиндре объемом
достигнут молекулы, заключенные в цилиндре объемом 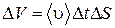 . Число таких молекул будет равно
. Число таких молекул будет равно
 ,
,
где 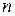 - концентрация молекул. Переданный стенке сосуда импульс за время
- концентрация молекул. Переданный стенке сосуда импульс за время  будет равен
будет равен
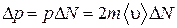 ,
,
где  - импульс, переданный стенке одной молекулой при абсолютно упругом ударе. Переписав последнее соотношение в виде
- импульс, переданный стенке одной молекулой при абсолютно упругом ударе. Переписав последнее соотношение в виде
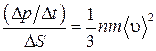
и перейдя к дифференциалам, получим
 .
.
Учтем, что

есть средняя кинетическая энергия поступательного движения молекул. Поэтому
 . (7)
. (7)
Выражение (7) представляет собой основное уравнение МКТ идеальных газов.
Термодинамическая температура. Сопоставим уравнения (7) и (5):
 ,
,
откуда
 . (8)
. (8)
Формула (8) раскрывает физический смысл термодинамической (или иначе абсолютной) температуры: абсолютная температура есть величина, пропорциональная кинетической энергии поступательного движения молекул.
Число степеней свободы. Закон равномерного распределения молекул по степеням свободы. Числом степеней свободы 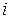 тела называется наименьшее число независимых координат, необходимых для полного определения положения тела в пространстве. При решении вопроса о числе степеней свободы применительно к молекулам газа обычно рассматривают три случая. Одноатомный газ: молекулы газа представляются в виде шариков очень малого размера (материальных точек), количество независимых координат (степеней свободы), определяющих положение молекулы в пространстве,
тела называется наименьшее число независимых координат, необходимых для полного определения положения тела в пространстве. При решении вопроса о числе степеней свободы применительно к молекулам газа обычно рассматривают три случая. Одноатомный газ: молекулы газа представляются в виде шариков очень малого размера (материальных точек), количество независимых координат (степеней свободы), определяющих положение молекулы в пространстве,  (координаты
(координаты  ,
,  и
и 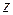 в декартовой системе координат). Двухатомный газ: в первом приближении двухатомная молекула может быть представлена в виде двух шариков-атомов, соединенных жесткой связью. Положение такой системы в пространстве определяется тремя координатами
в декартовой системе координат). Двухатомный газ: в первом приближении двухатомная молекула может быть представлена в виде двух шариков-атомов, соединенных жесткой связью. Положение такой системы в пространстве определяется тремя координатами  ,
,  и
и 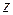 , задающими положение центра масс молекулы, и, кроме того, двумя углами
, задающими положение центра масс молекулы, и, кроме того, двумя углами  и
и 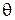 , определяющими ориентацию молекулы относительно осей координат
, определяющими ориентацию молекулы относительно осей координат  и
и  (см. рис. 2). Таким образом, двухатомная молекула с жесткой связью обладает числом степеней свободы
(см. рис. 2). Таким образом, двухатомная молекула с жесткой связью обладает числом степеней свободы 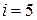 . Многоатомная молекула, т.е. молекула, имеющая в своем составе три и более атомов, при условии наличия только жестких связей между атомами имеет, как и абсолютно твердое тело, число степеней свободы, равное 6.
. Многоатомная молекула, т.е. молекула, имеющая в своем составе три и более атомов, при условии наличия только жестких связей между атомами имеет, как и абсолютно твердое тело, число степеней свободы, равное 6.
Ответ на вопрос о том, как распределятся средняя кинетическая энергия молекулы по степеням свободы, дает закон равномерного распределения энергии по степеням свободы:
на каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная  .
.
Согласно данному закону средняя кинетическая энергия молекулы газа, имеющей 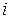 степеней свободы, равна
степеней свободы, равна
 . (9)
. (9)
Заметим здесь, что в общем случае при наличии у молекулы поступательных, вращательных и колебательных степеней свободы число степеней свободы 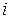 задается соотношением
задается соотношением
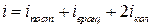 . (10)
. (10)
Число колебательных степеней свободы берется удвоенным потому, что модель колебательного движения молекулы в классической физике рассматривается в виде шариков, связанных пружинкой. При этом ясно, что в колебательном движении присутствует как кинетическая, так и потенциальная энергии, на каждую из которых согласно закону равнораспределения энергии должно приходиться по 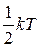 .
.
|
Дата добавления: 2014-01-07; Просмотров: 373; Нарушение авторских прав?; Мы поможем в написании вашей работы!