
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбционные и каталитические свойства полупроводников
В металлах – уровень Ферми – граничный, который отделяет полностью заполненные уровни от полностью свободных уровней при абсолютном нуле.
Уровень Ферми – средняя энергия всех возбужденных свободных носителей полупроводника.
Макродефекты – трещины, неровности поверхности.
Микродефекты – разбиваются на следующие группы:
| I | II | III | ||
| О О О О О О О О О О О О О О О Шотки | О О О О О О О О О О О О О О О О О Френкеля | О О О О О О О О О О ● О О О О О | О О О О О О О О О ● О О О О О О | О О О О О О О О ● О О О О О О О О |
I – механические дефекты
1). Пустой узел
2). Собственный атом в междуузлии
II. Электрические дефекты
Аномальный заряд иона в ионном кристалле.
III. Химические дефекты
1). Чужеродный атом в узле.
2). Чужеродный атом в междуузлии.
Микропримеси и дефекты решетки вызывают появление примесных уровней в запрещенной зоне. Эти уровни могут располагаться или ближе к зоне проводимости или ближе к валентной зоне. Если примесные уровни располагаются вблизи зоны проводимости, они называются донорными примесями, а полупроводники с донорными примесями – n – типа.
Zn++ O-- Zn++ O-- дефект
Zn0 Френкеля
Валентная O-- Zn++ O-- Zn++
зона
Донорные примеси поставляют электроны в зону проводимости и возникает электронная проводимость. Акцепторные уровни примесей расположены вблизи валентной зоны, что обеспечивает переход электронов из валентной зоны на эти уровни, в результате возникает дырочная проводимость. Полупроводники с примесью акцептора называются p – полупроводниками.
Например, закись Ni – NiO:
Ni++ O-- Ni++ O--
O-- Ni+++ O-- Ni+++ дефект Шотки
↑ ↑
Ni++ O-- □ O--
Кислородный каркас сохраняется, избыточный кислород достраивает решетку, в которой будут пустые места, т.е. где должен быть Ni+++:
-------------------------- акцепторный уровень Ni+++ □
________●_________
__________________
__________________
_________________
дырка, которая при наложении электрического поля может двигаться, обеспечивая электропроводность.
Примесная проводимость – при легировании NiO окисью Li:
Ni++ O-- Ni+++ O—
O-- Li+ O-- Ni++
Эта комбинация в данной модели дает локальный уровень, отвечающий состоянию Ni+++ Li+. Это обеспечивает дырочную проводимость.
----------●-------- Ni+++ Li+
____○________
_____________
_____________
Хотя число образованных примесями дополнительных уровней мало по сравнению с числом основных уровней, создаваемая ими добавочная χ во много раз превышает чистого вещества.
(Волькенштейн)
Адсорбционные и каталитические свойства зависят от свойств полупроводников. Эта зависимость вытекает из следующих соображений. Возьмем к примеру реакции окислительно-восстановительного типа. Механизм этих реакций связан с переходом электронов, процесс начинается с взаимодействия электронов или дырок твердого тела с реагирующими молекулами. Электроны и дырки являются основными действующими агентами в катализе этого класса.
На этой базе и развивалась электронная теория полупроводников катализа, причем, в первую очередь, электронные представления развиты применительно к адсорбции, т.к. адсорбция – 1 стадия катализа, поэтому рассмотрение катализа необходимо начинать с процессов адсорбции.
Эти представления Волькенштейн развивает для ионных кристаллов, причем решает 1-у и 2-х электронную задачу. Его представления не распространяются на металлы, т.к. они дают многоэлектронную задачу.
Рассмотрим адсорбцию одновалентного атома А типа H, Na на ионном кристалле, построенном из однозарядных ионов М+ и R-. Пока атом А находится далеко от поверхности полупроводника, валентный электрон является собственностью этого атома (а). Если же атом А посажен на поверхность, то его электрон принадлежит уже не только ему.
б а г
+ · + о +
● в +
· ·
- + - + - · + - + - + -
Он принадлежит всей системе в целом. При этом валентный электрон атома А оказывается в большей или меньшей степени затянутым в решетку. Этим затягиванием электрона в решетку и обусловливается связь между адсорбированным атомом А и кристаллом.
Таким образом, связь осуществляется только валентным электроном атома, в результате чего возникает слабая одноэлектронная связь (б).
Адсорбция может осуществляться за счет свободного электрона зоны проводимости. Здесь возникает двухэлектронная задача: электрон атома А и свободный электрон на поверхности решетки. Наличие свободного электрона на поверхности кристалла в зоне проводимости означает, что один из ионов М+ поверхностного слоя решетки нейтрализован электроном. Движение электрона в зоне проводимости означает, что электрон переходит с одного иона М+ на соседний ион М+ поверхностного слоя решетки и таким образом странствует по поверхности кристалла.
Если теперь атом А попадает на поверхность, но свободный электрон решетки не вступает во взаимодействие с атомом А, то адсорбция не происходит.
Если же атом А на поверхности встречается со свободным электроном решетки и оказывается адсорбированным. Атом А закрепляется на поверхности, а свободный электрон решетки закрепляется около атома. Возникает двухэлектронная связь того же типа, как в молекуле Н2. В результате взаимодействия электрон решетки теряет часть энергии и выпадает из зоны проводимости на некоторый локальный уровень в запрещенной зоне. Прочность возникающей связи зависит от того, насколько глубоко под зоной проводимости располагается локальный уровень.
Таким образом, свободный электрон решетки выступает в роли адсорбционного центра. Адсорбируемый же атом А локализует около себя свободный электрон решетки, закрепляя его в определенном месте на поверхности кристалла. Атом А, таким образом, играет роль «ловушки» для свободного электрона. Выпадение свободного электрона из зоны проводимости освобождает соответствующий энергетический электронный уровень. Врезультате возможен выход новых электронов на этот уровень и, как следствие, подобных процессов, число адсорбционных центров на поверхности увеличивается по мере ее заполнения.
Для атома, адсорбированного одноэлектронной связью не исключена возможность встречи со свободным электроном решетки и переход при этом в двухэлектронную связь.
Образование двухэлектронной связи и появление электрона на локальном уровне в запрещенной зоне может осуществляться двумя путями. Локализация электрона сопровождается выпадением его из зоны проводимости. Однако не исключена возможность появления электрона на локальном уровне за счет перехода его на локальный уровень из валентной зоны, чему должно соответствовать возникновение свободной дырки в валентной зоне.
При одноэлектронной связи затягивание электрона в решетку может привести к отрыву валентного электрона от атома и к образованию ионной формы адсорбции. При этом атом А перемещается по поверхности с адсорбционного центра М+ на центр R- и удерживается на поверхности электростатическими силами. Образованию ионной адсорбционной связи отвечает переход валентного электрона атома в зону проводимости или его рекомбинация с дыркой.
Если перенести эти выводы на атом, способный адсорбироваться с оттягиванием электрона поверхности (например, О), то картина, в целом, сохраняется, только в роли адсорбционных центров будут выступать дырки поверхности.
Число возможных адсорбционных связей заметно возрастает при переходе к сложным многовалентным атомам. Здесь уже необходимо учитывать образование связей с участием 3-х и 4-х электронов.
Если теперь от идеальной поверхности перейти к реальной, то необходим учет возможных дефектов на поверхности. Дефекты решетки могут выполнять двоякую роль. Некоторые из них могут быть акцепторами электронов и дырок, т.е. ловушками для электронов и дырок. Ввиду локализации свободного электрона или дырки у дефектов, их можно рассматривать как адсорбционные центры, благодаря наличию локализованного электрона или дырки. Другая часть дефектов может быть донором электронов, т.е. поставщиками электронов для зоны проводимости, тем самым увеличивая число возможных адсорбционных центров.
Таким образом, электронная теория вводит ряд новых представлений в процессы адсорбции:
1. Центры адсорбции не закреплены на поверхности кристалла, а блуждают по его поверхности. Только акт адсорбции закрепляет адсорбционный центр в определенном месте поверхности.
2. Возможность образования различных типов связи при хемосорбции за счет того, что хемосорбируемая частица может привлекать к участию в связи электрон или дырку.
3. Реакционная способность хемосорбированных частиц зависит от формы хемосорбции. При одних формах адсорбции частица может находится в виде радикалов или ион-радикалов, в других – образует с поверхностью валентно-насыщенное соединение.
4. Изменение формы адсорбции за счет локализации или делокализации электронов. При таком рассмотрении электроны кристаллической решетки оказываются непосредственными участниками химических процессов. Более того, не только участники, но и регуляторы этих процессов. Концентрация свободных электронов может определять относительное преобладание той или иной формы хемосорбции, результатом чего могут явиться изменение скорости и направления процесса.
Таким образом, реакции протекающие на поверхности кристалла, могут регулироваться концентрацией свободных электронов или дырок на поверхности. Отсюда вытекает возможность регулирования каталитического процесса на поверхности введением добавок и изменением условий реакции. Эти же положения позволяют объяснить возможный механизм действия вводимых добавок.
Следствием развиваемых представлений должно явиться наличие связи между адсорбционной и каталитической активностью полупроводника с одной стороны и его электропроводностью – с другой стороны.
Реакция на полупроводниках разделены на 2 класса:
- к одному классу относят реакции, ускоряемые электронами – это акцепторные реакции,
- второй класс составляют донорные реакции, ускоряемые дырками.
Каталитическая активность полупроводника при лимитирующей акцепторной стадии должна возрастать по мере увеличения электронной проводимости. Активность катализатора и его χ (электропроводность) увеличиваются с ростом концентрации электронов.
В отношении же донорных стадий увеличение электронной проводимости будет сопровождаться понижением активности контакта. Поэтому всякая примесь, будет являться промотором акцепторной стадии и ядом для донорной стадии. Если реакция протекает в двух параллельных направлениях, из которых одно является акцепторным, другое – донорным, то примесь будет изменять и селективность катализатора.
Одной из электронных характеристик полупроводника служит положение уровня Ферми. Для реакций, лимитирующихся донорной стадией, константа скорости реакции определяется уравнением:


Если реакция лимитируется акцепторной стадией, то:
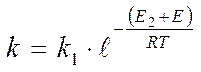

Е – расстояние уровня Ферми от зоны проводимости.
Расстояние уровня Ферми от зоны проводимости Е входит в качестве слагаемого в энергию активации реакции, определяя тем самым скорость реакции. Уровень Ферми выступает как регулятор каталитической активности и адсорбционной способности полупроводника:

С – концентрация свободных носителей.
Связь между σ и каталитической активностью
Реакции на полупроводниках разделяют на 2 класса – акцепторные, ускоряемые электронами, и донорные, ускоряемые дырками. Каталитическая активность полупровдника при лимитирующей стадии должна возрастать по мере увеличения электронной проводимости. Активность катализатора и его электропроводность увеличивается с ростом концентрации электронов. В отношении донорных стадий увеличение электронной проводимости будет сопровождаться понижением активности контакта. Поэтому всякая примесь, увеличивающая электронную проводимость, будет являться промотором акцепторной стадии и ядом для донорной стадии.
Эти представления предполагают наличие прямой зависимости между σ, ее типом и каталитической активностью, однако, как показывают экспериментальные данные, в большинстве случаев зависимость между электропроводностью и каталитической активностью является более сложной.
На фоне изложенных общих положений электронной теории на полупроводниках возник и остро дискутировался ряд хотя и частных, но тем не менее принципиальных вопросов. Наиболее актуальным был вопрос о влиянии положения уровня Ферми на каталитические и адсорбционные свойства полупроводника. Впервые возможное влияние уровня Ферми отмечено Волькенштейном в 1950 г. Позднее этот вопрос рассматривался Бударом, а затем Хауфе. Проведенные расчеты привели к выводу, что для реакций, лимитирующихся донорной стадией константа скорости реакции определяется уравнением:


При катализе снижение уровня Ферми должно ускорять реакции, в которых лимитирующая стадия связана с переходом электрона к катализатору, и замедлять, если лимитирующая стадия связана с переходом электрона из катализатора к реагирующему веществу.
При снижении уровня Ферми надо ожидать в соответствии с рассматриваемой теорией улучшения хемосорбции акцепторов электронов, а при повышении уровня Ферми – улучшения хемосорбции доноров.
Таким образом, уровень Ферми выступает регулятором каталитической и адсорбционной способности полупроводника.
|
Дата добавления: 2014-01-07; Просмотров: 1080; Нарушение авторских прав?; Мы поможем в написании вашей работы!