
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атомного ядра. Субатомные частицы. Элементы. Изотопы
|
|
|
|
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несут положительный заряд.
В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом - нейтральная частица, не несущая заряда.
Атом может потерять один или несколько электронов или наоборот - захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Масса нейтрона практически не отличается от массы протона.
Электроны, протоны и нейтроны являются главными "строительными деталями" атомов и называются субатомными частицами. Их заряды и массы в кг и в специальных “атомных” единицах массы (а.е.м.) показаны в таблице 2-1.
Таблица 2.1.
Субатомные частиц
| Частица | Заряд | Масса: | |
| кг | а.е.м. | ||
| Протон | +1 | 1,67·10-27 | 1,00728 |
| Нейтрон | 1,67·10-27 | 1,00867 | |
| Электрон | -1 | 9,11·10-31 | 0,000549 |
Из таблицы 2.1 следует, что массы субатомных частиц чрезвычайно малы. Поэтому массу субатомных частиц удобнее выражать в атомных единицах массы (сокращенно - а.е.м.). За атомную единицу массы принята ровно 1/12 часть массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов. Схематическое изображение такого "эталонного" атома углерода приведено на рис. 2.2 (б). Атомную единицу массы можно выразить и в граммах: 1 а.е.м. = 1,660540·10-24 г.
Содержание этого изотопа в природном углероде составляет чуть более 1%. Линейные размеры атомов очень малы: их радиусы составляют от 0,3 до 2,6 ангстрема (1 ангстрем = 10-8 см). Радиус ядра около 10-5 ангстрема, то есть 10-13 см. Это в 100000 раз меньше размеров электронной оболочки.
|
|
|
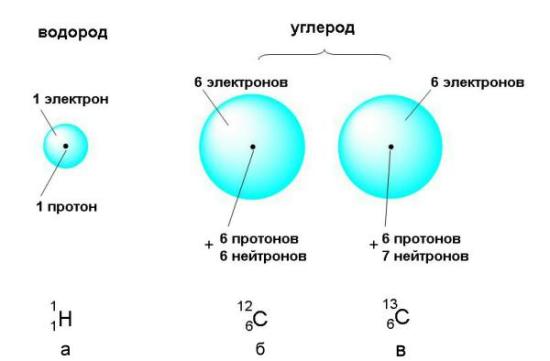
Рис. 2.2. Атомы состоят из положительно заряженного ядра и электронного облака. а) В состав ядра атома водорода входит только 1 протон, а электронное облако заполняется одним электроном. б) В ядре атома углерода 6 протонов и 6 нейтронов, а в электронном облаке - 6 электронов. в) Существует также изотопный углерод, ядре которого на 1 нейтрон больше.
Масса атома, выраженная в килограммах или граммах, называется абсолютной атомной массой. Чаще пользуются термином относительная атомная масса, которая выражается в атомных единицах массы (а.е.м.). Относительная атомная масса представляет собой отношение массы какого-нибудь атома к массе 1/12 части атома углерода. Иногда говорят более коротко: атомный вес. В учебниках пользуются термином относительная атомная масса, которую обозначают символом Ar. Здесь "r" - от английского "relative" - относительный. Например, Ar = 12,0000 – относительная атомная масса углерода 126C равна 12,0000. В современной научной литературе относительная атомная масса и атомный вес - синонимы.
На рис. 2.2 показаны атомы двух разных видов. Может возникнуть вопрос: почему двух, а не трех видов - ведь на рисунке изображены три атома? Дело в том, что атомы (б) и (в) относятся к одному и тому же химическому элементу углероду, в то время как атом (а) - совсем другой элемент (водород). Что же такое химические элементы и чем они отличаются друг от друга?
Водород и углерод отличаются числом протонов в ядре и, следовательно, числом электронов в электронной оболочке. Число протонов в ядре атома называют зарядом ядра атома и обозначают буквой Z. Это очень важная величина. Когда мы перейдем к изучению Периодического закона, то увидим, что число протонов в ядре совпадает с порядковым номером атома в Периодической таблице Д.И.Менделеева.
|
|
|
Как мы уже говорили, заряд ядра (число протонов) совпадает с числом электронов в атоме. Когда атомы сближаются, то в первую очередь они взаимодействуют друг с другом не ядрами, а электронами. Число электронов определяет способность атома образовывать связи с другими атомами, то есть его химические свойства. Поэтому атомы с одинаковым зарядом ядра ведут себя в химическом отношении практически одинаково и рассматриваются как атомы одного химического элемента.
Элементом называется вещество, состоящее из атомов с одинаковым зарядом ядра.
Сумма тяжелых частиц (нейтронов и протонов) в ядре атома какого-либо элемента называется массовым числом и обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента.
A = Z + N
Здесь A - массовое число атома (сумма протонов и нейтронов), Z - заряд ядра (число протонов в ядре), N - число нейтронов в ядре.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 456; Нарушение авторских прав?; Мы поможем в написании вашей работы!