
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кларки концентраций элементов
|
|
|
|
Периодическая система элементов, как основа геохимических классификаций
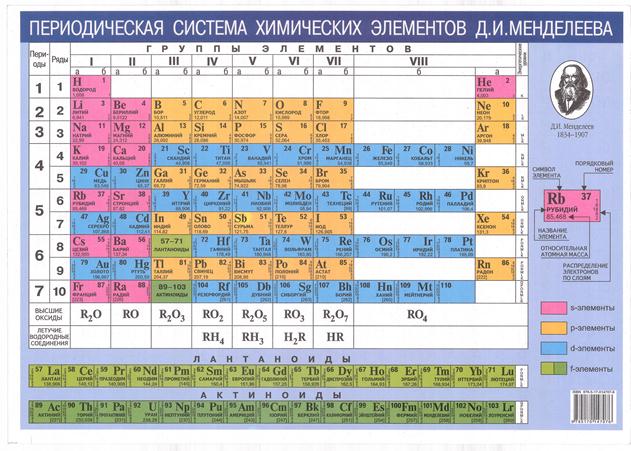
|
Рис. 2.5. Периодическая система элементов Д.И.Менделеева
Основой практически всех геохимических классификаций является Периодическая таблица химических элементов Д.И. Менделеева, где атомы по их химическим свойствам разбиты на группы и ряды, и которая, поэтому может рассматриваться как наиболее ранний вариант не только химической и, но и геохимической классификации.
Используя строение электронных оболочек, обуславливающее химические свойства элементов, положение элементов на кривой атомных объёмов, химическое «сродство» к тем или иным конкретным элементам, т.е. преимущественную склонность именно с этими определёнными элементами образовывать соединения (может измеряться значениями энергии образования определённых типов их соединений, например, оксидных) В.М. Гольдшмидт создал в 1924 году одну из наиболее широко применяемых классификаций. В ней элементы подразделены на 4 группы:
Литофильные - Li, Be, B, O, F, Na, Mg, Al, Si, P, Cl, K, Ca, Sc, Ti, V, Cr, Mn, Br, Rb, Sr, Y, Zr, Nb, I, Cs, Ba, TR, Hf, Ta, W, At, Fr, Ra, Ac, Th, Pa, U. Включены кислород и галогены, а также ассоциирующие с ними элементы, то есть преимущественно образующие кислородные и галоидные соединения.
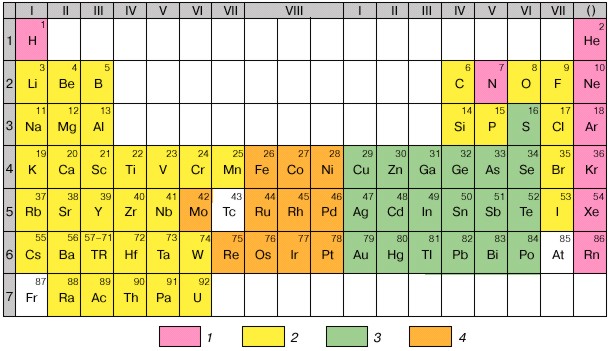
Рис. 2.6. Периодическая система и геохимическая классификация химических элементов: 1 - атмофильные, 2 - литофильные, 3 - халькофильные, 4 - сидерофильные.
Последние – это те, которые расположены на пиках и нисходящих участках кривых атомных объёмов, а также имеют максимальные величины энергии образования оксидных соединений. Построены на модели атома благородных газов, наружная оболочка из 8 электронов (2 и 6р). Сродство к О,F, Cl.
|
|
|
Халькофильные (или тиофильные, «любящие» серу) – S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po). Те, которые ассоциируют преимущественно с медью и серой. Это – сера и её аналоги (селен, теллур), а также элементы, преимущественно склонные образовывать не оксидные, а сульфидные соединения. Для последних характерны 18-электронные внешние оболочки катионов, расположение на восходящих участках кривых атомных объёмов. Величины энергии образования кислородных соединений низкие. Некоторые способны существовать в самородном виде. Построены на модели атома благородных газов, наружная оболочка из 18 электронов (2s, 6p и 10d) за исключением Se, S, Te, As, Sb.
Сидерофильные - Fe, Co, Ni, Mo, Ru, Rh, Pd, Re, Os, Ir, Pt. Ассоциируют с железом. Все принадлежат к элементам с достраивающимися d-оболочками. Занимают промежуточное положение между лито- и халькофильными: минимумы на кривой атомных объёмов, промежуточные значения энергии образования кислородных соединений. В равной мере распространены и в оксидных, и в сульфидных ассоциациях. Ионы переходного типа с числом электронов в наружной оболочке от 8 до 18.
Атмофильные – все инертные газы, N, H. Все являются газами, свойственно по преимуществу атомарное или молекулярное (вне соединений) состояние (видимость того, что Н представляет исключение, связана с тем, что атомарный водород теряется, рассеиваясь в космическом пространстве).
Неправомерным является дополнение этой классификации группой биофильных элементов.
Исходя из периодической системы различными исследователями предпринимались неоднократные попытки геохимической классификации элементов, которая давала бы возможность по положению элементов в периодической системе объяснить поведение его в природных процессах и его естественные ассоциации с другими элементами.
Классификация В.И. Вернадского основана на следующих признаках:
1. Присутствие или отсутствие в истории данного химического элемента химических и радиоактивных процессов;
|
|
|
2. Характер этих процессов – обратимость или необратимость;
3. Присутствие или отсутствие в истории химических элементов в Земной коре их химических соединений или молекул, состоящих из нескольких атомов.
Согласно этим признакам В.И. Вернадский элементы на 6 геохимических групп, которые представлены в табл. 2.2.
Таблица2.2
Геохимические группы элементов. По В.И. Вернадскому
| Номер группы | Групппа | Элементы | % |
| I | Благородные газы | He, Ne, Ar, Kr, Xe | 5 5.44 |
| II | Благородные металлы | Ru, Rh, Pd, Os, Ir, Pt, Au | 7 7.66 |
| III | Циклические элементы | H, B, C, N, O, F, Na, Mg, Al, Si, P, S, Cl, K, Ca, Ti, V, Mn, Fe, Co, Ni, Cu, Zn, As, Se, Sr, Mo, Ag, Cd, Ba, (Be, Cr, Ge, Zr, Sn, Sb, Te, Hf, W, Re, Hg, Tl, Pb, Bi | 44 47.82 |
| IV | Рассеянные элементы | Li, Sc, Ga, Br, Rb, Y, Nb, In, J, Cs, Ta | 11 11.95 |
| V | Элементы сильно радиоактивные | Po, Rn, Ra, Ac, Th, Pa, U | 7 7.61 |
| VI | Элементы редких земель | La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tu, Yb, Lu | 15 16.30 |
1. Благородные газы. Соединения с другими атомами образуют исключительно редко, поэтому в природных химических процессах значительного участия не принимают.
2. Благородные металлы. Соединения редки. Преимущественно присутствуют в форме сплавов, и образуются в основном в глубинных процессах (магматических, гидротермальных).
3. Циклические элементы. Наиболее многочисленная группа и преобладающая по массе. Для каждого элемента характерен определённый круг химических соединений, возникающих и распадающихся в ходе природных процессов. Таким образом, каждый элемент проходит цепочку превращений, в конечном счёте возвращаясь к исходной форме нахождения – и далее. Циклы не являются полностью обратимыми, так как часть элементов постоянно выходит из круговорота (и часть так же снова в него вовлекается).
4. Рассеянные элементы. Безусловно, господствуют рассеянные атомы, не образующие химических соединений. Незначительная доля может участвовать в образовании самостоятельных минеральных соединений (большинство – в глубинных процессах, а J и Br – в гипергенных).
5. Редкоземельные элементы. Тяготеют к рассеянным. Основная черта – совместная миграция.
6. Радиоактивные элементы - Po, Rn, Ra, Ac, Th, Pa, U. Основная специфика в том, что в геохимическом процессе происходит постоянное превращение одних элементов в другие, что делает процессы их химической миграции наиболее сложными.
|
|
|
Элементы условности данной классификации:
· наличие химических элементов, занимающих промежуточное положение между группами, т.е. способных вести себя в миграционных процессах двояко; в этих случаях для отнесения такого элемента к одной из двух возможных групп «решающим аргументом будет история главной по весу части атомов или наиболее яркие черты их геохимической истории» (наличие доли субъективизма в таком критерии очевидно).
· выделение в особую группу радиоактивных элементов не учитывает разной устойчивости изотопов; у ряда элементов существенной является доля как стабильных, так и нестабильных изотопов, и, естественно, геохимическая история соответствующих долей общего числа атомов данного элемента будет различной (K, Rb, Sm, Re и др.). Сейчас, в связи с процессами радиогенного загрязнения, необходимо учитывать и миграцию искусственных радиоактивных изотопов.
Кроме упомянутых геохимических классификаций существуют и многие другие (Н.А. Солодова, А.Н. Заварицкого и др.), но они, как правило, носят либо слишком общий, либо слишком частный характер и в современной геохимии используются мало.
В природе существуют механизмы, позволяющие обеспечивать формирование повышенных концентраций тех или иных элементов, в результате чего их содержание в каких-то участках могут многократно превышать кларковые. Поэтому кроме кларка элемента нужно учитывать и величину его концентрации в сравнении с кларковым содержанием.
Для этого введено понятие «кларк концентрации» (или «коэффициент концентрации»). Последний термин более корректен, так как понятие кларка введено именно для средних содержаний, и лучше для характеристики содержаний повышенных такой же термин не использовать. Но всё же в литературе вы часто можете встретить именно термин «кларк концентрации».
Коэффициент концентрации (КК) – это соотношение содержания химического элемента в данном конкретном природном вещественном агрегате (горной породе и т.п.) к его кларку.
|
|
|
На этом основании элементы с низкими кларками подразделяются на две уже известные вам качественно различные группы. Те, для распределения которых не характерны высокие значениями КК, называются рассеянными (Rb, Ga, Re, Cd и др.). Способные формировать повышенные концентрации с высокими значениями КК – редкими (Sn, Be и др.).
Различиями в достигаемых величинах КК обусловлена разная роль тех или иных элементов в истории материально-технической деятельности человечества (с древности известные металлы с низкими кларками Au, Cu, Sn, Pb, Hg, Ag … - и более распространённые Al, Zr…).
Большую роль в процессах концентрации и рассеяния элементов в земной коре играет изоморфизм.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3624; Нарушение авторских прав?; Мы поможем в написании вашей работы!