
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Среда миграции
Миграция - это процесс перемещения химических элементов в пространстве и во времени, приводящий к их концентрации или рассеянию.
Среда миграции может быть твёрдой (диффузия), жидкой (истинные и коллоидные растворы, расплавы, взвеси или суспензии) или газообразной (газовые смеси, взвеси, дымы – смесь газа и твердых частиц, аэрозоли, туманы – смесь газа и частиц жидкости, флюидизаты).
Очень многие химические соединения хорошо растворимы в воде (табл. 1) и миграция входящих в их состав элементов происходит в ионной форме (K, Na, Cl и др.), поэтому здесь необходимо особо остановиться на необычных свойствах воды как растворителя.
Таблица 7.1
Растворимость кислот, оснований и солей в воде
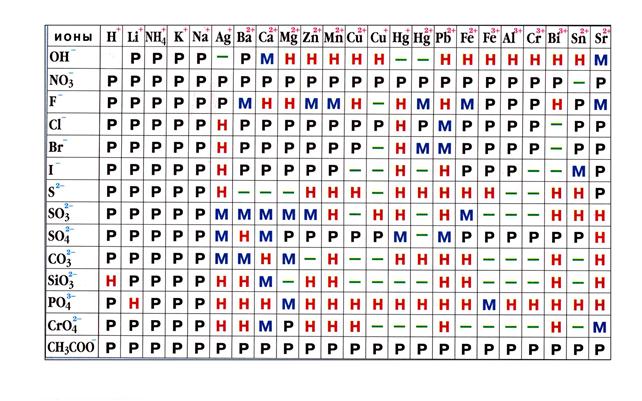
Примечание: Р-растворимые, М-малорастворимые, Н-нерастворимые, прочерк – разлагаются водой или не существуют
Никакая другая жидкость не может сравниться с водой ни по числу веществ, которые могут в ней растворяться, ни по количеству вещества, которое она может удерживать в растворе. Объяснение этих замечательных свойств следует искать в структуре воды, о которой мы говорили ранее. Вы помните, что каждая молекула воды является миниатюрным диполем. Важным следствием дипольной природы молекул воды является ее очень высокая диэлектрическая постоянная – 80. Высокая диэлектрическая проницаемость как раз и объясняет активность воды как растворителя ионных соединений. Это связано с тем. Что силы притяжения ионов друг к другу уменьшаются пропорционально диэлектрической проницаемости среды, а растворение ионных соединений не что иное, как разрыв ионов, составляющих молекулу растворяемого вещества молекулами растворителя. В растворе катионы притягивают отрицательные полюсы ближайших диполей молекул воды, а анионы – положительные полюсы диполей. Этот процесс, как Вам известно из курса химии, называется гидратацией. Число молекул воды, окружающих каждый ион напрямую зависит не только от размеров этого иона, но и от плотности заряда на его поверхности. То есть гидратация иона возрастает с увеличением его заряда (Z) и убывает с увеличением его радиуса (r). Величина Z/r, называемая ионным потенциалом, определяет не только гидратацию данного иона, но и многие другие его свойства в водных растворах. По существу, ионные потенциалы являются мерой электроотрицательности, т.к. - чем меньше радиус положительного иона и чем больше его заряд, тем более ярко выражены кислотные свойства соответствующего окисла. И, наоборот, чем больше радиус и чем меньше заряд, тем сильнее соответствующее основание. Положительный заряд поверхности иона отталкивает протоны, входящие в состав молекул воды, координированных вокруг него. Если это отталкивание достаточно сильно, некоторые из протонов могут отрываться от молекул воды, в результате чего заряд центрального иона нейтрализуется образовавшимися гидроксильными группами. В результате – может выпадать в осадок нерастворимая гидроокись.
В истинных растворах элементы присутствуют либо в виде отдельных ионов, либо входят в состав растворимых комплексных ионов. Вам должно быть известно, что на растворимость тех или иных соединений существенно влияют и такие параметры природных вод как их общая минерализация, ионный состав, кислотность-щелочность, окислительно-восстановительный потенциал. Все эти рассмотренные нами геохимические параметры вод в первую очередь определяют миграцию химических элементов в ионной форме. Но в водной среде возможны и иные формы физико-химической миграции элементов. Одна из таких форм – миграция в коллоидных растворах.
Факторы миграции подразделяются на внутренние и внешние.
Внутренние факторы миграции определяются строением атомов. От них зависит способность элементов давать летучие, растворимые или инертные формы. К ним относятся:
· электростатические свойства ионов:
· ионный потенциал – отношение заряда иона к его радиусу,
· энергетический коэффициент ионов);
· свойства связи соединений, включая строение кристаллической решетки (определяют способность соединения противостоять разрушению);
· химические свойства соединений (это уже с учётом условий среды – например, более высокой устойчивости кислородных соединений в большинстве гипергенных обстановок);
· гравитационные свойства атомов (проявляются при кристаллизации, седиментации, выветривании);
· радиоактивные свойства.
Внешние факторы миграции - ландшафтно-геохимические условия, определяющие поведение элементов в различных химических (окислительно-восстановительных, щёлочно-кислотных) обстановках:
· температура (в целом повышение ускоряет физико-химическую миграцию, а для некоторых видов миграции, например, биогенной, нужны определённые диапазоны температур);
· давление (повышение давления в равновесной системе приводит к изменению системы в сторону уменьшения объёма);
· степень электролитической диссоциации (зависит от соотношения свойств растворителя и растворяемого вещества, температуры раствора и его концентрации);
· концентрация водородных ионов, определяющая кислотность-щёлочность среды (pH);
· окислительно-восстановительный потенциал;
· поверхностные силы коллоидных систем (определяют масштабы селективной сорбционности);
· комплексы типоморфных ионов в почвах и водах (что такое типоморфные ионы – будет рассмотрено далее);
· геоморфологические факторы (рельеф);
· радиационные характеристики среды;
· жизнедеятельность организмов и техногенез – наиболее сложные по механизму влияния.
Результат миграции – это рассеяние и концентрация химических элементов.
Перемещение химических элементов в пределах земной коры, гидросферы и атмосферы может происходить главным образом в виде водных растворов, расплавов и газов. Законы движения вещества в составе поверхностных, глубинных и ювенильных вод представляют для нас наибольший интерес. Рассмотрим некоторые особенности поведения истинных растворов.
|
|
Дата добавления: 2014-01-07; Просмотров: 628; Нарушение авторских прав?; Мы поможем в написании вашей работы!