
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
І явища, що відбуваються на ній
|
|
|
|
25.1. Поверхня твердого тіла
Поверхня твердого тіла - особлива, дуже важлива область зі специфічними властивостями, що відрізняються від його об'ємних властивостей. Інтенсивне дослідження поверхонь твердих тіл і явищ, що на них відбуваються, зв'язано з розв’занням наукових і практичних задач таких галузей техніки, як мікроелектроніка, хімія, особливо каталітична хімія, тонкоплівкова технологія і матеріалознавство, техніка нанесення покрить, іонна імплантація і модифікування поверхні, зварювання. Важко переоцінити важливість розуміння властивостей і процесів, що відбуваються на поверхні твердих тіл, оскільки у своїй практичній діяльності звичайно маємо справу саме з поверхнею твердих матеріалів. Крім того, дослідження останніх років показали, що навіть такі, здавалося б, сугубо об'ємні властивості, як міцність і втомлення металів, також багато в чому визначаються властивостями їхньої поверхні.
Поверхня твердого тіла являє собою "обрив" його об’єму, вона порушує симетрію його структури і разом з так званим приповерхневим шаром утворює особливу нерівноважну область. Хоча розуміння цього фундаментального факту закладено ще в термодинамічних дослідженнях Дж. В. Гіббса, систематичне вивчення поверхні повною мірою стало можливо тільки з появою нових тонких методів дослідження таких, як електронографія, скануюча електронна мікроскопія, методи дифракції повільних електронів, мікровагові методи, екзоелектронна емісія, методи хімічної і фізичної адсорбції та ін.
Численні роботи в нашій країні і за кордоном показали, що поверхні належать різноманітні явища й ефекти, які відрізняють її від об’єму всього тіла. У науці з'явився новий розділ - фізика і хімія поверхні.
|
|
|
Будь-яка механічна обробка твердого матеріалу - стругання, різання, абразивно-струменеве очищення приводять до виникнення "свіжої" поверхні, що характеризується нерівноважним станом. У природних умовах навколишнього середовища перехід поверхні в рівноважний стан супроводжується різними процесами: адсорбцією газів, пари і рідин чи окислюванням та утворенням різних твердих плівок, дифузійним проникненням у приповерхневий шар і об’єм підкладки різних елементів і т.д. На ці явища при експлуатації чи тривалому збереженні впливають різні зовнішні фактори: склад навколишнього середовища і його тиск, світло, тепло, різні випромінювання, магнітні й електричні поля, що прискорюють, а іноді і сповільнюють зазначені процеси.
Залежно від поставленої технічної чи наукової задачі поверхні твердих матеріалів виражають різними моделями.
Любий атом, чи, точніше, іон, розташований в об’ємі твердого тіла, піддається симетричній дії сил з боку інших навколишніх атомів. Основною структурною ознакою поверхні, а також її специфічною властивістю є порушення цієї симетрії. Атом на поверхні має менше, ніж в об’ємі, число найближчих сусідів, і усі вони розташовані по один бік. Тому поверхню твердого тіла розглядають одночасно із шаром атомів, що прилягають до нього, тобто з приповерхневим шаром атомів, який багато в чому визначає властивості самої поверхні. Цей шар утворюється внаслідок того, що втрата симетрії частково компенсується зміною в упакуванні атомів поблизу поверхні твердого тіла порівняно з його об’ємом. Однак повного відновлення не відбувається і тому поверхня і приповерхній шар являють собою особливу нерівноважну область твердого тіла, глибина якої може складати кілька параметрів ґратки.
Найбільш простий випадок - коли поверхня є "атомно-чистою", тобто вільною від молекулярних комплексів, атомів, чи молекул іонів яких-небудь інших речовин. Розглянемо таку поверхню.
|
|
|
Залежно від величини і характеру викривлень кристалічної гратки, поверхні умовно підрозділяються на зміщені і перебудовані.
Атоми на "зміщеній" поверхні зрушені на невеликі відстані, зв'язки між ними не порушуються і залишаються такими ж, як і в об’ємі твердого тіла.
Атоми на "перебудованій" поверхні не знаходяться в положеннях, що відповідають рівноважним позиціям у ґратках даного кристала. При цьому зв'язки, характерні для об’єму кристала, можуть бути порушені і замінені специфічними поверхневими зв'язками.
25.2. Явища, що відбуваються на поверхні металу, на який наносять покриття
Вимірювання показують, що зсуви, характерні для приповерхневого шару, звичайно стосуються п'яти - шести атомних шарів, які прилягають до поверхні.
Виникнення поверхні в металевому кристалі істотно впливає на розподіл вільних електронів у металі. На поверхні відбувається згладжування електронної щільності. З поверхні починається емісія електронів, так звана екзоелектронна емісія. Видалення електронів з поверхні спричиняє появу позитивного заряду в шарах, що прилягають до поверхні. Останнє, у свою чергу, приводить до появи негативного заряду на поверхні, тобто в поверхні утворюється подвійний заряджений шар.
Характер теплових коливань атомів поверхні відрізняється від коливань атомів у об’ємі твердого тіла. Поверхні, необхідні для дослідження описуваних явищ, звичайно одержують розколюванням кристалів у вакуумі. Методом дифракції повільних електронів було визначено, що в сріблі середній квадрат компоненти амплітуди атомних коливань, перпендикулярних до поверхні і паралельних їй, більше ніж відповідні значення коливань у об’ємі кристала. Аналогічні результати були отримані і для інших металів, наприклад міді і нікелю. Амплітуда коливання атомів на поверхні може перевищувати амплітуду коливань в об’ємі до двох разів.
Для кристалів з ковалентним зв'язком на поверхні може відбутися порушення симетрії валентних оболонок атомів. У кристалі валентна оболонка перебуває в деякому гібридизованому стані, симетрія якого відповідає симетрії упакування атомів у кристалі. Часто симетрія гібридизованої валентної оболонки визначає симетрію упакування атомів і, отже, симетрію розподілу мас і сил взаємодії атомів, як наприклад в алмазі чи кремнії та германії.
|
|
|
У металах, в яких хімічний зв'язок здійснюється усуспільненими електронами, порушення симетрії валентних оболонок атомів поверхні майже не відбувається, а порушення симетрії сил відштовхування між іонами компенсується колективом вільних електронів.
Утворення поверхні в іонних кристалах практично теж не порушує симетрії валентних оболонок. Наприклад, валентні оболонки аніонів в NaCl викривлюються на поверхні лише слабкою мірою. Розглянемо схему поверхні (100), що є границею спайки іонного кристалу. Така поверхня складається з іонів з симетричними електронними облонками (рис. 25.1).
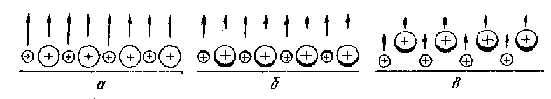
Рис. 25.1. Утворення зміщеної поверхні (100) іонного кристала
Лекція 26. Фізична та хімічна неоднорідність металічних
поверхонь
26.1. Фізична неоднорідність
Ідеальний кристал можна уявити у вигляді нескінченно протяжної тривимірної системи точок, для однорідності якої необхідно, щоб елементарні комірки просторової ґратки були розташовані строго упорядковано. Розташування вузлів у ґратках може мати симетрію кожної з 230 просторових груп. Неідеальний кристал має різного роду відхилення від точної періодичності. Звичайно розрізняють відхилення у вигляді точкових і лінійних дефектів.
Точкові дефекти можуть виникати в результаті дифузії атомів з об’єму на поверхню кристала. У цьому випадку в ґратках утворюються вільні вузлові об’єми - вакансії. Такі дефекти називаються дефектами Шотткі. З положення рівноваги атоми можуть переміщатися в міжвузля ґратки, залишаючи свої місця вакантними. Такі дефекти називають дефектами Френкеля.
У твердому тілі можуть також існувати відхилення від паралельності окремих структурних елементів і площин кристалічних ґраток. Такі відхилення спричиняє поява дислокацій. Можливі два граничних види дислокацій: крайова і гвинтова. Шляхом сполучення цих двох видів можна представити будь-яку конкретну дислокацію.
|
|
|
Якщо в частину об’єму монокристалу вставити зайву атомну площину, то спотворювання монокристала буде зосереджено на краю введеної площини. Під крайовою дислокацією розуміють лінію, що проходить по краю зайвої атомної площини. Тому дислокація являє собою лінійний дефект на відміну від точкових дефектів. Область поблизу дислокаційної лінії, де спотворення ґратки найбільш великі, називають ядром дислокації.
Візьмемо монокристал і розріжемо його на деяку глибину. Зрушимо одну частину монокристала щодо іншої його частини уздовж площини розрізу на один параметр ґратки. Лінія спотворень, що йде уздовж краю розрізу, називається гвинтовою дислокацією.
Точкові і лінійні дефекти знаходяться на будь-якій реальній поверхні твердого тіла. При нанесенні покрить взаємодія починається в першу чергу на дефектах поверхні, оскільки розташовані поблизу їх атоми виведені з рівноважних стійких положень і володіють високою потенційною енергією і, отже, хімічно більш активні.
В атомних масштабах поверхня реального кристала є шорсткуватою. На ній під дією теплового руху атомів постійно утворюються сходинки й інші дефекти. Розглянемо модель, що ілюструє характерні положення атомів на поверхні найпростішої, а саме кубічної ґратки (рис. 26.1). На такій поверхні атоми можуть знаходитися в таких положеннях: на цілком заповненому краї 1, у вершині кута 2, на цілком заповненій поверхні 3, на незаповненому краї 4, у вершині незаповненого кута 5, на ступені 6 і на поверхні 7. З усіх положень атома найбільше цікаве і важливе для практики положення напівкристала 1/2, що частіше зустрічається при поступовому вирощуванні кристалів і вакуумному нанесенні покрить. Особливістю такого положення атома є те, що поверхнева енергія кристала не змінюється залежно від його приєднання чи видалення з поверхні. Дійсно, зі схеми видно, що кількість граней, що виходять на поверхню кристала, від такої операції не змінюється.
Сили зв'язку, що діють на атом з боку сусідніх атомів, дуже сильно залежать від його положення на поверхні кристала. Для металів і сполук, що мають ковалентний зв'язок, з достатньої для практики точністю можна вважати, що енергія зв'язку між атомами адитивна. Тому, якщо енергію зв'язку найближчих сусідів і сусідів, що знаходяться за ними, позначити відповідно Е1, і Е2 (де Е2»0,1Е1), то повна енергія зв'язку для атома чи іона усередині кристала, наприклад для кубічних кристалічних ґраток, може бути представлена у вигляді Е = 6Е1 + 12Е2. Природно, атоми, що знаходяться на поверхні твердого тіла, будуть мати меншу енергію зв'язку.Залежно від положення атома її величина буде зменшуватися так: Е(3)>Е(1)>Е(1/2)>Е(2)>Е(6)>Е(7)>Е(4)>Е(5).
Зі схеми поверхні кристала легко можна підрахувати величину енергії атомів у різних положеннях: Е(1) = 4Е1 + 5Е2; Е(2) = ЗЕ1+ЗЕ2; Е(3) = 5Е1+8Е2; Е(4) = Е1 + 3Е2; Е(5) = Е1 + 2Е2; Е(6) = 2Е1 + 6Е2; Е(7) = Е1 + 4Е2; Е(1/2) = 3Е1 + 6Е2.
Реальна металева поверхня, крім атомної шорсткості, має багато інших дефектів. До них у першу чергу належать дефекти, що виникають у місцях виходу на поверхню дислокацій і границь зерен. Експериментально вихід дислокацій виявляють у вигляді фігур травлення чи фігур випару, що виникають у результаті обробки поверхні в спеціальних середовищах. Сліди виходу границь зерен мають вигляд канавок на поверхні кристала. На рис. 26.1 показано вихід на поверхню кристала вакансії 8, крайової дислокації 9 і гвинтової 10. Видно, що гвинтова дислокація, що вийшла з об’єму кристала на його поверхню, має вигляд сходинки.

Рис. 26.1. Схема можливих характерних положень атомів і вихід дефектів на поверхню кристала з кубічними ґратками.
Зв'язок по поверхні між кубами ілюструє діючу енергію зв'язку в кристалі Е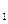 - а по гранях куба енергію Е
- а по гранях куба енергію Е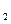
Стан реальних поверхонь твердих матеріалів значною мірою визначається також їхнім походженням. Більшість металевих поверхонь одержують шляхом механічної обробки. Тому навіть після ретельного доведення, наприклад полірування тонкими абразивами, поверхневий шар металу сильно спотворюється і є наклепаним, що проявляється у вигляді виходу великої кількості дефектів на його поверхню. Якщо рухатися з твердого тіла до його поверхні, то будову поверхневого шару схематично можна представити так: неушкоджена основа; перехідна зона; зона орієнтованих кристалів з величиною зерна меншою, ніж основи; зона дрібних неорієнтованих кристалів; оксидна плівка і розташовані на ній адсорбовані гази. Товщина такого шару залежить від природи металу й умов його обробки, але рідко буває менше ніж 50 мкм. Особливо зростає кількість дефектів поверхні при абразивно-струменевій обробці, що широко застосовується для підготовки поверхонь виробів під покриття.
26.2. Хімічна неоднорідність поверхонь
Застосовувані в техниці речовини і матеріали, навіть дуже чисті, завжди містять деяку кількість чужорідних атомів. Ці домішкові атоми на поверхні відіграють роль хімічних дефектів. Елемент, що є присутнім у металі в невеликих кількостях, часто може концентруватися на поверхні, впливаючи на її стан і на її енергію. Особливо велика роль хімічних дефектів у процесах окислювання металів. Оскільки перебудова поверхні і приповерхневого шару металу не приводить до повної втрати її хімічної активності, то в атмосферних умовах метали швидко покриваються тонким шаром оксидів з товщиною від декількох десятків до декількох сотень ангстрем.
Блиск, властивий металевій поверхні, не зникає аж до товщини плівки, що дорівнює 100 А. Оксидна плівка на "свіжій" металевій поверхні утвориться при звичайній температурі протягом декількох годин, а іноді і днів. Якщо помістити метал в досить глибокий вакуум (133,3 • 10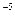 133,3
133,3 10
10 Па) то окислювання не буде усунено, а лише сповільнюється.
Па) то окислювання не буде усунено, а лише сповільнюється.
Тільки цінні метали - золото, платина, срібло не мають на поверхні оксидних плівок при звичайних температурах. Вони покриті так званим комплексом адсорбції кисню. Комплекс адсорбції відрізняється від оксиду структурою і міцністю хімічних зв'язків і може бути цілком вилучений нагріванням твердого тіла.
До хімічних недосконалостей поверхні можна віднести присутність на ній органічних речовин і різних жирів. На ретельно очищеній поверхні металу швидкість виникнення мономолекулярного шару жирної кислоти дуже велика. Шари жирної кислоти сильно впливають на протікання реакцій на поверхні й затрудняють такі технологічні операції, як нанесення покрить, зварювання, склеювання. Тому жирові забруднення в першу чергу підлягають ретельному видаленню.
Лекція 27. Поверхнева енергія, зв'язок її з кристалічною
будовою металів
27.1. Поверхнева енергія
Мінімальна енергія, що необхідна для утворення одиниці площі поверхні розділу фаз в умовах постійного об’єму і температури, називається поверхневою енергією чи енергією поверхні розділу. Розглянемо поверхневу енергію твердого тіла, що межує з газом.
Приймемо модель структури твердого тіла, в якій атоми (чи іони) представлені у вигляді твердих куль. Розташування цих куль відносно один одного може бути різним залежно від способу розміщення атомів у ґратках даного твердого тіла.
У твердих кристалічних матеріалах розташування атомів чи молекул - це періодично повторювана в трьох вимірах структура. Порядок, властивий розташуванню атомів твердого тіла, часто приводить до симетрії його зовнішньої форми, особливо якщо кристали вирощені в спеціальних умовах. Наприклад, порошки металів і сполук, отримані відновленням чи конденсацією з парової фази, звичайно мають чітке огранювання.
У більшості хімічних сполук, що використовуються як покриття (оксиди, карбіди, нітриди, боріди), кристалічні структури дуже складні.
Тому розглянемо основні геометричні співвідношення і властивості кристалічних структур на металах, що мають більш просту будову.
Найбільш нескладна структура (рис. 27.1) - це проста кубічна (ПК). В елементарному кубі такої структури атоми розташовані тільки у вершинах куба. Тому атоми дотикаються один до одного уздовж ребер куба. Ця структура має нещільне упаковування. Кожен атом має усього 6 найближчих сусідів. Така структура зустрічається дуже рідко, тільки в одного елемента полонію.
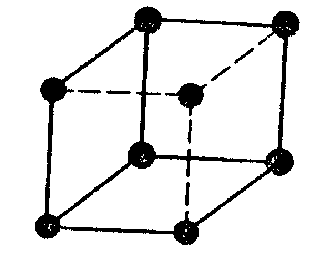
Рис. 27.1. Розташування атомних центрів у простих кубічних ґратках

Рис. 27.2. Схема розташувань атомів у кристалі з гексагональною
щільноноупакованою структурою (ГЩУ)

Рис. 27.3. Схема розташувань атомних центрів у ГЦК ґратках
Однак вона становить інтерес тому, що з її допомогою можна спростити багато напівкількісних розрахунків і зробити найпростіші теоретичні висновки. Крім того, деякі більш складні кристалічні структури можна представити як набір уставлених одна в одну простих кубічних підграток. Наприклад, ОЦК ґратку можна розглядати як систему з двох однакових простих кубічних ґраток, причому в одній з них атоми знаходяться у вершинах кубів, а інша містить центральні атоми.
У металів часто зустрічається гексагональна щільноупакована (ГЩУ) структура (рис. 27.2) Вона виникає при складанні щільноупакованих площин у такій послідовності: дві щільноупаковані площини стикаються таким чином, що кожен атом однієї площини міститься в поглибленнях між трьома атомами сусідньої площини. Ця структура називається щільноупакованою тому, що вона має максимальну щільність упаковування, яка тільки можлива для твердих куль. Кожна куля оточена дванадцятьма найближчими сусідами: шість знаходяться в тій же площині, три - у верхній площині і три - у нижній площині. Відстань a між центрами сусідніх атомів називається атомним діаметром.
У гранецентрованій кубічній (ГЦК) ґратці атоми (рис. 27.3) займають усі вершини куба і центр кожної грані. Атоми торкаються один одного уздовж діагоналей граней. ГЦК структура також щільноупакована кожен атом має дванадцять найближчих сусідів.
Методи укладання щільноупакованих площин, що приводять до побудови кристалічних структур ГЩУ і ГЦК, практично вичерпують усі найпростіші способи укладання. Однак багато матеріалів мають структури, що утворюються не з щільноупакованих площин. Одна з таких структур - об’ємноцентрований куб (ОЦК) (рис. 27.4). Така елементарна комірка являє собою куб з атомами в кожній вершині й у центрі.
Структура не має щільного упакування, оскільки кожен атом оточений тільки вісьма сусідами. Дотик атомів відбувається уздовж діагоналей куба. Усі хімічні сполуки мають інші більш складні структури. Багато деякі з них являють собою комбінації однієї з тільки що розглянутих основних кубічних структур. У цих комбінаціях одні ґратки проникають усередину інших. Наприклад, структура алмазу являє собою сполучення двох ГЦК підграток, вставлених одна в одну, і є нещільноупакованою, тому що кожен атом оточений тільки чотирма найближчими сусідами.

Рис. 27.4 Схема розташувань атомних центрів в ОЦК ґратах
Практичний інтерес становлять такі характеристики атомної будови: 1) координаційне число, тобто кількість найближчих сусідніх атомів; 2) атомний радіус, що є половиною відстані між найближчими сусідами в кристалі (ця відстань дається в частках ребра куба а); 3) відносна щільність упакування, що є відношенням об’єму, зайнятого сферичними атомами, до об’єму, що зайнятий структурою:
Тип структури ПК ОЦК ГЦК Ґратки алмазу
Координаційне
Число 6 8 12 4
Атомний радіус а/2 а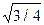 а
а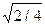 а
а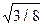
Кількість атомів в
елементарному
кубі 1 2 4 8
Щільність упакування 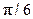
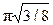

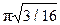
Число атомів у другій
координаційній сфері 12 6 6 12
У силу того, що в атомів на поверхні відсутні сусіди з однієї сторони, їхня енергія більше, ніж в атомів усередині ґратки. Надлишок енергії атомів на поверхні є причиною виникнення поверхневої енергії.
Теоретичне й експериментальне визначення величини поверхневої енергії - складна задача. Однак зіставлення розрахункових і експериментальних значень показує, що найбільш достовірні результати дає визначення її через рівняння, що зв'язують теплоту сублімації з ближнім порядком у кристалі. Ця теорія застосовна найбільшою мірою для оцінки поверхневої енергії металів і оксидів.
Мірою сил міжатомного зчеплення твердого тіла може служити енергія зв'язку, або енергія атомізації Es. Енергія зв'язку - це енергія, необхідна для поділу твердого тіла на нейтральні атоми. Для металів Es прийнято вважати її дорівнюючою теплоті сублімації металу ΔHS. Величину Es розраховуть виходячи з ряду напівемпіричних залежностей, і ці дані можна знайти в довідковій літературі з термодинамічних властивостей речовин.
Розглянемо кристал, що містить один моль речовини, з координаційним числом Z. У ньому міститься N атомів, а кількість зв'язків дорівнює 1/2 ZN. Оскільки міжатомні сили діють на короткій відстані, то можна припустити, що поверхнева енергія виникає завдяки зв'язкам між найближчими сусідами. Отже, енергія одиничного міжатомного зв'язку Е1 дорівнює теплоті сублімації ΔHS, розділеній на загальну кількість зв'язків:
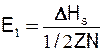 (27.1)
(27.1)
Розглянемо кристали з ГЦК ґратками. Нехай поверхня відколу кристала утворить площину (111). Кожен атом на площині (111) зв'язаний із шістьма сусідніми атомами на цій площині, трьома атомами нижньої площини і з трьома атомами на верхній площині. Тому при утворенні поверхні розриваються по три зв'язки в кожного атома. Однак при розколюванні утворюються дві поверхні, так що число розірваних зв'язків на кожен атом дорівнює 3/2. Таким чином, для утворення поверхні на кожен атом необхідно затратити енергію:
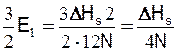 (27.2)
(27.2)
Якщо на площині (111) є N0 атомів на 1 см2, то одержимо поверхневу енергію
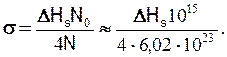 (27.3)
(27.3)
Для типових атомів з діаметром близько 0,3 нм величина N0 складає 1015 на 1 см2. Звідси, наприклад, для срібла, золота і міді, вона складає відповідно 1,14; 1,55 і 1,38 Дж/м2, що задовільно збігається з експериментальними даними.
При кристалізації і при поліморфних перетвореннях у твердому стані, тобто коли відбувається упорядкування чи перебудова ґраток металу, вона змінюється стрибком. Необхідно вміти правильно оцінювати величину цієї зміни.
Для грубих оцінок можна прийняти, що при затвердінні металу його поверхнева енергія  тв збільшується приблизно від 1,1
тв збільшується приблизно від 1,1 ж до 1,3
ж до 1,3 ж порівняно з поверхневою енергією рідкого металу
ж порівняно з поверхневою енергією рідкого металу  ж. Зв'язок між цими величинами виражається такою залежністю:
ж. Зв'язок між цими величинами виражається такою залежністю:
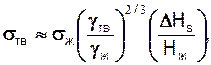 (27.4)
(27.4)
де 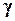 tb і
tb і 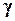 ж ~ густина металу у твердому і рідкому станах відповідно;
ж ~ густина металу у твердому і рідкому станах відповідно;  HS і Нж - теплоти сублімації і випаровування. Використовуючи типові значення вказаних величин, можна одержати, що
HS і Нж - теплоти сублімації і випаровування. Використовуючи типові значення вказаних величин, можна одержати, що  тв
тв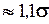 ж.
ж.
Більш детально поверхневу енергію твердого тіла можна знайти теоретично з розрахунку енергії, необхідної для його поділу площиною на дві частини. При цьому тільки необхідно врахувати зсув атомів, про який згадувалось раніше, на поверхнях, що утворилися у новому положенні, яке відповідає мінімуму енергії.
Для ковалентного кристала, що має твердий напрямлений зв'язок, можна теж визначити поверхневу енергію. Для цього необхідно підрахувати число зв'язків, які необхідно розірвати на даній кристалічній площині для утворення 1 см поверхні, а їхню енергію можна визначити за теплотою утворення твердого тіла.
поверхні, а їхню енергію можна визначити за теплотою утворення твердого тіла.
Поверхневу енергію іонного кристала знайти складніше, тому що для нього характерним є набагато більший зсув поверхневих атомів, ніж для неіонних кристалів. Тому в цьому випадку не можна обмежуватися розташуванням найближчих сусідів.
Поверхнева енергія - важлива характеристика, від якої залежить відбування багатьох процесів. Вона визначає змочування й адгезію матеріалів у рідкофазних процесах, таких як наплавлення, пайка, оплавлення покрить і їхнє просочення розплавами. Від поверхневої енергії залежать міцність зчеплення, зародження і зростання покриття при його нанесенні вакуумними методами. Вона визначає імовірність утворення зародків нової фази при фазових переходах у хімічних реакціях і при кристалізації. При зростанні кристалів імовірність утворення зародків залежить від того, чи можуть зародки збільшуватися до критичних розмірів, а їхньому зростанню перешкоджає, головним чином, загальне збільшення вільної енергії за рахунок поверхневої енергії виникаючих і зростаючих зародків.
Змочуваність твердого тіла характеризується крайовим кутом, що визначається широко відомими термодинамічними рівняннями, які містять поверхневу енергію й енергію поверхні розподілу твердої і рідкої фаз. Розтікання рідини по поверхні твердого тіла зумовлено зменшенням вільної енергії. Воно відбувається тоді, коли величина поверхневої енергії твердого тіла перевищує суму поверхневої енергії рідини й енергії поверхні розподілу між твердим тілом і рідиною.
Лекція 28. Адсорбція і хемосорбція
28.1. Адсорбція і хемосорбція на поверхні металів
Адсорбція - це здатність твердого тіла (від лат. ad - на і sorbeo - поглинаю) - адсорбента - утримувати на своїй поверхні атоми і молекули іншої речовини - адсорбата.
Адсорбція відбувається під дією некомпенсованих сил міжатомної взаємодії в поверхневому шарі адсорбента, які притягують молекули адсорбата з приповерхневої області. Адсорбція зменшує поверхневу енергію адсорбента і є початковою стадією процесу взаємодії між твердою речовиною і газом.
У середньому на 1 см чистої металевої поверхні доводиться близько 1015 адсорбційних позицій. З кінетичної теорії газів випливає, що при тиску 133,3 • 10
чистої металевої поверхні доводиться близько 1015 адсорбційних позицій. З кінетичної теорії газів випливає, що при тиску 133,3 • 10 Па і температурі 20 оС чиста металева поверхня покриється мономолекулярним шаром адсорбованого газу приблизно через 2 год. Тільки зі застосуванням ультраглибоковакуумної техніки з'явилася можливість досліджувати чисті металеві поверхні та їхню взаємодію з газом. Усі дані отримані й опубліковані в літературі раніше, були проведені на металах або з забрудненою адсорбованим газом поверхнею, або покритих тонким шаром оксидної плівки ще до початку дослідів.
Па і температурі 20 оС чиста металева поверхня покриється мономолекулярним шаром адсорбованого газу приблизно через 2 год. Тільки зі застосуванням ультраглибоковакуумної техніки з'явилася можливість досліджувати чисті металеві поверхні та їхню взаємодію з газом. Усі дані отримані й опубліковані в літературі раніше, були проведені на металах або з забрудненою адсорбованим газом поверхнею, або покритих тонким шаром оксидної плівки ще до початку дослідів.
Прийнято розрізняти фізичну і хімічну адсорбцію, хоча існує багато проміжних видів взаємодії молекул з поверхнею твердого тіла. При фізичній адсорбції адсорбований шар зв'язаний з поверхнею твердого тіла, наприклад силами Ван-дер-Ваальса, а при хімічній адсорбції (скорочено хемосорбції) - силами хімічного зв'язку, що виникають у результаті хімічної взаємодії адсорбату з поверхнею твердого адсорбенту. Існує ряд ознак, за якими слід відрізняти хімічну адсорбцію від фізичної, хоча не завжди можна провести чітке розмежування між ними.
Звичайним критерієм служить розходження в теплоті адсорбції. Теплота фізичної адсорбції, як правило, не перевищує 40 кДж/моль. Оскільки хімічні зв'язки міцніші, теплота хемосорбції складає в окремих випадках понад 400 кДж/моль. Однак зустрічаються випадки, коли теплота хемосорбції є величиною того ж порядку, що і теплота фізичної адсорбції, і тоді за результатами виміру теплоти адсорбції важко установити природу досліджуваного процесу.
Фізична адсорбція оборотна, а хемосорбція здебільшого буває необоротною.
Фізична адсорбція є неактивованим процесом і відбувається майже миттєво, як тільки молекули газу торкаються до твердої поверхні. При хемосорбції реакція може протікати повільно, оскільки зв'язана з визначеною енергією активації. Тому хемосорбцію іноді називають активованою адсорбцією. Однак при взаємодії газів з чистими металевими поверхнями спостерігається дуже швидка хемосорбція. У цих умовах зв'язок атомів на поверхні металу не насичений і хемосорбція відбувається без помітної енергії активації.
Ще однією відмінністю хемосорбції є її залежність від кристалографічної орієнтації зерен, наявності дефектів на поверхні адсорбату. Вона починається і переважно розвивається на "активних" місцях і ділянках поверхні.
При зменшенні тиску газу фізична адсорбція зменшується. Хемосорбція менш чутлива до тиску. Крім того, прийнято вважати, що хемосорбція відбувається тільки доти, поки вся поверхня не покриється мономолекулярним шаром адсорбату.
При підвищенні температури фізична адсорбція може переходити в хемосорбцію. Для цього необхідно, щоб теплова енергія системи перевищувала енергію активації процесу хемосорбції. Схематично адсорбцію газу на поверхні твердого тіла при постійному тиску і перехід від фізичної адсорбції до хемосорбції зображено на рис. 28.1. При низьких температурах ізобара 1 описує фізичну адсорбцію, при якій кількість адсорбованого газу зменшується зі зростом температури. При подальшому збільшенні температури кількість адсорбованого газу збільшується (кр.2), що відбувається внаслідок початку хемосорбції. Потім поверхня заповнюється адсорбатом, і кількість газу, що поглинається, знову починає знижуватися (кр.3). Адсорбція в області 1 оборотна, а в області 2 необоротна, при охолодженні процес переходить з області 3 в область 4. Кількість адсорбованої речовини залежить від тиску (тобто від його концентрації
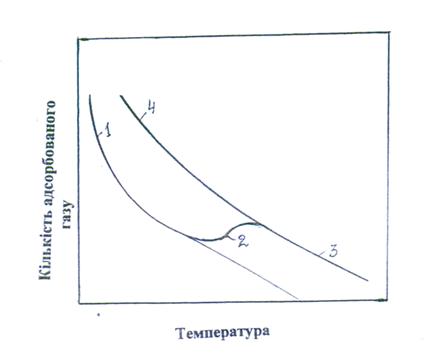
Рис. 28.1. Залежність зміни кількості адсорбованого газу при
постійному тиску від температури

Рис. 28.2. Ізотерми адсорбції
і температури). При постійній температурі, чим вище тиск чи концентрація адсорбованої речовини, тим більша його кількість адсорбується на поверхні твердого тіла. Коли адсорбент знаходиться в зіткненні з газом, то кількість адсорбованої речовини зростає, а концентрація навколишніх його молекул знижується доти, поки швидкість десорбції не стане дорівнювати швидкості адсорбції, тобто поки не установиться адсорбційна рівновага. Рівновагу можна зрушити. Наприклад, якщо збільшити тиск (чи концентрацію) газу, то кількість адсорбованої речовини зростає до нового рівноважного значення. Якщо ж тиск зменшити, то адсорбент буде виділяти адсорбовану речовину доти, поки знову не установиться адсорбційна рівновага.
Зсув рівноваги використовують у технології покрить для очищення поверхні виробу перед нанесенням покрить. Для очищення поверхні тиск знижують, тобто створюють вакуум, а підкладку підігрівають. Даним часом у спеціальній апаратурі одержують вакуум до 133,3·10-9 - 133,3·10-11 Па. У техниці нанесення покрить звичайно використовують вакуум 133,3·10-4 - 133,3 ·10-6 Па.
28.2. Закономірності адсорбції
Адсорбцію вивчають, досліджуючи залежність між кількістю адсорбованого газу і тиском при постійній температурі. За формулою отриманої ізотерми адсорбції судять про її характер. На рис. 28.2 представлена ізотерма адсорбції Ленгмюра з насиченням, що відбувається при утворенні мономолекулярного шару на поверхні твердого тіла. Для багатошарової адсорбції характерна ізотерма іншого виду (рис. 28.2,б). Ізотерми такого виду характерні, головним чином, при фізичній адсорбції. Зустрічаються й інші типи ізотерм, але представлені два типи найбільш характерні.
Звичайно будують графік залежності об’єму V речовини, адсорбованого на 1 г адсорбенту від співвідношення Р/Р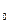 , де Р
, де Р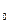 - тиск пари, що насичує, при температурі експерименту; Р - поточний тиск.
- тиск пари, що насичує, при температурі експерименту; Р - поточний тиск.
Дуже спрощена модель адсорбції була запропонована Ленгмюром. Рівняння Ленгмюра широко застосовують для інтерпретації даних по адсорбції, оскільки його легко вивести і зрозуміти.
Вивід рівняння Ленгмюра заснований на ряді допущень. Передбачається, що поверхня твердого тіла складається з елементарних ділянок, на кожній з яких може адсорбовуваться лише одна молекула газу. Ці елементарні ділянки еквівалентні одна одній по адсорбційній здатності, і закріплення молекули на одній з ділянок не впливає на властивості сусідніх ділянок. При настанні адсорбційної рівноваги швидкість випаровування адсорбованого газу дорівнює швидкості його конденсації.
З кінетичної теорії газу випливає, що швидкість випаровування з частково заповненої поверхні пропорційна площі поверхні F, покритої адсорбованим газом. Тому, якщо через v позначити швидкість випаровування з цілком зайнятої атомами адсорбату поверхні, то швидкість випаровування з поверхні, частково зайнятої атомами, складе vF. Швидкість адсорбції молекул на поверхні адсорбенту пропорційна частині незайнятої поверхні (1 -F) і тиску газу Р. При рівновазі маємо
vF = к(1 - F)P чи F = кР/(v + кР) = [(к/v)P]/[1 + (k/v)P], де к - константа для визначеної температури, яка враховує, що не кожна молекула газу, яка ударяється в незайняту ділянку поверхні, має енергію, необхідну для закріплення на ній.
Оскільки об’єм адсорбованого газу V пропорційний F, то останнє рівняння можна переписати у вигляді V = аbР/(1 + аP), де а = k/v; b - константа.
З рівняння Ленгмюра випливає, що при низьких тисках, коли аP<<1, об’єм адсорбованого газу прямо пропорційний тиску Р.
У міру зростання тиску обсяг адсорбованої речовини збільшується й асимптотично наближається до величини b, що відповідає умові наближення до повного заповнення поверхні атомами адсорбату, тобто до утворення моношару.
Константи а і b знаходять графічно, будуючи залежності 1/ V від 1/Р, тому що 1/ V = 1/b+ 1/(аbР).
Якщо ізотерма має вигляд, зображений на рис. 28 б, то вона описує утворення декількох атомних шарів на поверхні твердого тіла. Такий тип ізотерми спостерігається при фізичній адсорбції. Для багатошарової адсорбції Брунауер, Еммет і Теллер вивели рівняння ізотерми адсорбції БЕТ. Рівняння ізотерми багатошарової адсорбції БЕТ виводиться на основі рівняння Ленгмюра з тими ж допущеннями. Передбачається, що рівняння Ленгмюра застосовне до кожного наступного шару і що енергія адсорбції, що визначає величину константи b, дорівнює теплоті випаровування рідкого адсорбату для всіх шарів вище першого. У найпростішій формі рівняння БЕТ записується так:
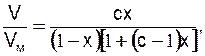 (28.1)
(28.1)
де х = Р/Р0; Р0 - тиск пари, що насичує, при температурі адсорбції;
Р - фактичний тиск; V/ V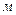 - відношення загального об’єму адсорбо-ваного газу до об’єму моношару при умові, що він покрив усю поверхню адсорбенту; с - константа при даній температурі.
- відношення загального об’єму адсорбо-ваного газу до об’єму моношару при умові, що він покрив усю поверхню адсорбенту; с - константа при даній температурі.
Рівнянню БЕТ можна додати й іншого вигляду
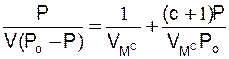 . (28.2)
. (28.2)
Відповідно до запису в такому вигляді залежність Р/[V(Р0 - Р)] від Р/Р0 на графіку дає пряму лінію з нахилом (с - 1)/VMc і відрізком 1/Vмс.
Площу, зайняту однією молекулою адсорбованої речовини на поверхні, можна обчислити, виходячи з густини зрідженої речовини. Наприклад, площа, зайнята молекулами азоту при -195 °С, дорівнює 1,62 нм2 у припущенні, що молекули мають сферичну форму і стикаються одна з одною у рідині. З вимірюваного значення VM обчислюють площу поверхні адсорбенту.
Рівняння БЕТ використовують при визначенні дійсної площі поверхні порошків, покрить, пористих тіл, а також інших твердих матеріалів з важкодоступною поверхнею. Для визначення поверхні звичайно досліджується адсорбція інертних газів і по перегину на ізотермі адсорбції (рис. 28.2, б точка М) знаходять заповнення поверхні моношаром адсорбат.
У наступних теоретичних роботах ця модель була удосконалена. Одним з недоліків моделі БЕТ, так само як і моделі Ленгмюра, є те, що в ній не враховується енергетична неоднорідність і відповідно нееквівалентність у відношенні адсорбційної здатності різних ділянок поверхні. На поверхні реального твердого тіла цим ділянкам відповідають різні теплоти адсорбції. Звідси також випливає, що в міру заповнення поверхні адсорбентом теплота адсорбції зменшується, оскільки процес відбувається на усе менш активних ділянках поверхні.
Перехід від фізичної до хімічної адсорбції можна проілюструвати на основі схематичної діаграми потенціальної енергії розглянутої системи (рис. 28.1). Дуже популярний опис явища адсорбція-десорбція був запропонований Леннардом-Джонсом. Цей опис був використаний для трактування початкової стадії утворення міцного з'єднання при твердофазному зварюванні, а також виявився дуже корисним для розуміння процесу утворення міцного зчеплення з основою покрить, нанесених газотермічним напилюванням. Енергія системи, що складається з металевої поверхні й адсорбованих на ній молекулах чи атомах, змінюється залежно від відстані між ними.
Діаграма (рис. 28.3) дає якісне уявлення про зміну енергії такої системи при фізичній і хімічній адсорбції. Точка Мх відповідає положенню стабільної рівноваги атома з енергією хімічного зв'язку qx, фіксованого на відстані Rх від поверхні після дисоціації молекули газу. Точка МF відповідає положенню стабільної рівноваги недисоційованої молекули з енергією фізичного зв'язку qF на відстані RF від поверхні. З діаграми (рис. 28.3) видно, що для переходу адсорбованої молекули, наприклад кисню О , від стану фізичної адсорбції з енергією теплоти адсорбції qF до більш стабільного стану хімічної адсорбції з енергією qx, тобто з різницею енергії qx - qF. необхідно перебороти енергетичний бар'єр висотою Eа. Величина Еа є енергією активації хімічної адсорбції газу на поверхні твердого тіла.
, від стану фізичної адсорбції з енергією теплоти адсорбції qF до більш стабільного стану хімічної адсорбції з енергією qx, тобто з різницею енергії qx - qF. необхідно перебороти енергетичний бар'єр висотою Eа. Величина Еа є енергією активації хімічної адсорбції газу на поверхні твердого тіла.
Для того щоб від фізичної адсорбції МF молекула газу перейшла в стан хемосорбції Мх, їй необхідно отримати додаткову енергію, достатню для досягнення рівня точки В. На цьому рівні молекула дисоціює (пунктирна крива) на атоми, що хемосорбуються поверхнею твердого тіла.
Таким чином, для переходу від фізичного до хімічної взаємодії при різниці в енергіях зв'язку qx - qF необхідно перебороти енергетичний бар'єр висотою Eа (рис. 28.3).
Енергію активації десорбції також можна визначити з діаграми потенціальної енергії адсорбент-адсорбуюча речовина. Ця енергія активації дорівнює різниці енергій у точках Мх і В.
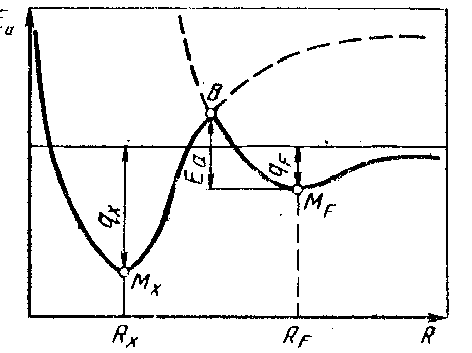
Рис. 28.3. Зміна потенційної енергії системи Е
при фізичній і хімічній адсорбції
Типовим прикладом взаємодії газу з поверхнею твердого тіла є окислювання металів. Для більшості металів енергія активації хемосорбції кисню мала. У результаті великої стабільності комплексу адсорбції кисню на металах енергія активації десорбції в цьому випадку значно вища, ніж енергія активації хемосорбції. Останньою часто можна знехтувати і тоді енергія активації десорбції стане дорівнювати енергії (теплоті) адсорбції qx. Тому в першому наближенні енергію (теплоту) хемосорбції кисню на поверхні металу можна визначити виміром енергії активації десорбції
Запитання для самоперевірки
1. Особливості напилювання чистих металів.
2. Сплави металів та умови їхнього напилювання різними методами.
3. Покриття, одержані зі сплавів на основі нікелю, кобальту та міді.
4. Особливості напилення сполук металоїдного типу, наприклад в системі Ni – Al.
5. Умови напилення металоїдних сполук типу карбідів.
6. Які фізико-хімічні процеси відбуваються у карбідних частинках при їхному нагріванні в процесі напилення?
7. Яка роль пластичної фази в системі карбід-метал?
8. Які властивості покрить із порошків TiC-метал?
9. Структура та властивості покрить, одержаних на основі карбідів хрому і вольфраму.
10. Особливості нанесення покрить із нітридів.
11. Умови нанесення покрить із боридів.
12. Термодинамічні умови напилення оксидних покрить.
13. Явища, що відбуваються на поверхні металу, на який наносять
покриття.
14. Фізична неоднорідність поверхні.
15. Хімічна неоднорідність поверхні.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 534; Нарушение авторских прав?; Мы поможем в написании вашей работы!