
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сталкиваются между собой и со стенками сосуда абсолютно упруго
|
|
|
|
Законы идеальных газов.
Опр.3.2.1. Идеальным называется газ, молекулы которого
1. имеют пренебрежимо малый собственный объем,
2. не взаимодействуют друг с другом на расстоянии,
Т.е. и деальным газом называется газ, в котором отсутствуют силы межмолекулярного взаимодействия. С достаточной степенью точности газы можно считать идеальными в тех случаях, когда рассматриваются их состояния, далекие от областей фазовых превращений.
 Напр., при нормальных условиях (давление
Напр., при нормальных условиях (давление 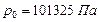 и температуре
и температуре 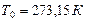 ) водород, гелий, неон, азот, кислород, воздух и др. можно считать с хорошим приближением идеальными.
) водород, гелий, неон, азот, кислород, воздух и др. можно считать с хорошим приближением идеальными.
Для идеальных газов справедливы законы:
а) Закон Бойля-Мариотта. При изотермическом процессе произведение объема данной массы газа (масса неизменна) на давление есть величина постоянная
произведение объема данной массы газа (масса неизменна) на давление есть величина постоянная  . (3.2.1.)
. (3.2.1.)
Для двух состояний газа закон записывается в виде , (3.2.1’.)
, (3.2.1’.)
где  и
и 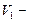 давление и объем газа в начальном состоянии,
давление и объем газа в начальном состоянии, 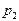 и
и  давление и объем газа в конечном состоянии.
давление и объем газа в конечном состоянии.
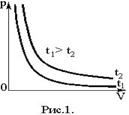
Графически этот закон в координатах РV изображается линией, называемой изотермой (рис.1). Изотермы – гиперболы, расположенные на графике тем выше, чем выше температура процесса.
б) Закон Дальтона. Давление меси различных газов равно сумме парциальных давлений газов, составляющих смесь:  . (3.2.2.)
. (3.2.2.)
в) Закон Гей-Люссака. При изобарическом процессе
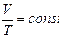 . (3.2.3.)
. (3.2.3.)
 (при постоянном давлении объем данной массы газа прямо пропорционален его абсолютной температуре).
(при постоянном давлении объем данной массы газа прямо пропорционален его абсолютной температуре).
Для двух состояний газа 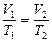 , (3.2.3’.)
, (3.2.3’.)
где  и
и  абсолютная температура и объем газа в начальном состоянии,
абсолютная температура и объем газа в начальном состоянии,  и
и  абсолютная температура и объем газа в конечном состоянии.
абсолютная температура и объем газа в конечном состоянии.
Если температура выражена по шкале Цельсия, то  , (3.2.3”.)
, (3.2.3”.)
где  температура по шкале Цельсия,
температура по шкале Цельсия,  объем газа при температуре
объем газа при температуре  ,
,  объем газа при температуре
объем газа при температуре  ,
,  коэффициент объемного расширения газов (для идеальных газов
коэффициент объемного расширения газов (для идеальных газов  ,
, 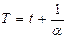 ).
).
|
|
|
 Графически зависимость объема от температуры изображается прямой линией – изобарой (рис. 2). При очень низких температурах (близких к –273°С) закон Гей-Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.
Графически зависимость объема от температуры изображается прямой линией – изобарой (рис. 2). При очень низких температурах (близких к –273°С) закон Гей-Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.
г) Закон Шарля. При изохорическом процессе 
 . (3.2.4.)
. (3.2.4.)
(при постоянном объеме давление данной массы газа прямо пропорционально его абсолютной температуре).
Для двух состояний газа 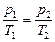 , (3.2.4’.)
, (3.2.4’.)
где  и
и  -абсолютная температура и давление газа в начальном состоянии,
-абсолютная температура и давление газа в начальном состоянии, 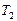 и
и 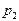 - абсолютная температура и давление газа в конечном состоянии.
- абсолютная температура и давление газа в конечном состоянии.
Если температура выражена по шкале Цельсия, то  , (3.2.4”.)
, (3.2.4”.)
где  температура по шкале Цельсия,
температура по шкале Цельсия, 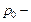 давление газа при температуре
давление газа при температуре  ,
, 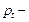 давление газа при температуре
давление газа при температуре  ,
,  коэффициент объемного расширения газов (для идеальных газов
коэффициент объемного расширения газов (для идеальных газов  ,
,  ).
).
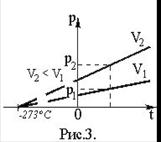
Графическая зависимость давления от температуры изображается прямой линией – изохорой (рис. 3).
д) Закон Авогадро: при одинаковых давлениях и одинаковых температурах и равных объемах различных идеальных газов содержится одинаковое число молекул; или, что то же самое: при одинаковых давлениях и одинаковых температурах грамм-молекулы различных идеальных газов занимают одинаковые объемы.
Например, при нормальных условиях (t = 0°C и p = 1 атм = 760 мм рт. ст.) грамм-молекулы всех идеальных газов занимают объем 22,414 л. Число молекул, находящихся в 1 см 3 идеального газа при нормальных условиях, называется числом Лошмидта; оно равно 2,687*1019> 1/см3
е) Объединенный газовый закон (уравнение Клапейрона):
 - (3.2.5.)
- (3.2.5.)
- объединение законов Бойля- Мариотта и Гей – Люссака: для данной массы какого-либо идеального газа произведение давления на объем, деленное на термодинамическую температуру, есть величина постоянная.
Газовая постоянная  зависит от химического состава газа и пропорционально его массе. Т.к.
зависит от химического состава газа и пропорционально его массе. Т.к.  ,где
,где  удельный объем газа, то уравнение Клапейрона можно переписать:
удельный объем газа, то уравнение Клапейрона можно переписать:  (3.2.5’.)
(3.2.5’.)
|
|
|
- у равнение состояния идеального газа.
где р, 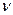 и Т - давление, молярный объем и абсолютная температура газа, а
и Т - давление, молярный объем и абсолютная температура газа, а 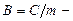 удельная газовая постоянная, зависящая только от химического состава газа.
удельная газовая постоянная, зависящая только от химического состава газа.
Запишем уравнение (3.2.5.) в форме  или
или 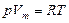 , (3.2.6.)
, (3.2.6.)
где  универсальная (молярная) газовая постоянная, численно равная работе, совершаемой 1 молем идеального газа при изобарном нагревании на один градус:
универсальная (молярная) газовая постоянная, численно равная работе, совершаемой 1 молем идеального газа при изобарном нагревании на один градус:  . (3.2.7.)
. (3.2.7.)
Ее величина найдена экспериментально.
Для произвольной массы  газа объем составит
газа объем составит  и уравнение состояния имеет вид:
и уравнение состояния имеет вид:  , (3.2.8.)
, (3.2.8.)
где 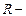 универсальная газовая постоянная,
универсальная газовая постоянная, 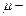 масса киломоля газа,
масса киломоля газа,  масса газа.
масса газа.
Это уравнение называется уравнением Менделеева - Клапейрона.
Следствия уравнения Менделеева – Клапейрона:
- плотность газа
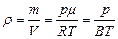 . (3.2.9.)
. (3.2.9.) - число молекул в единице объема
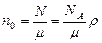 . (3.2.10.)
. (3.2.10.) - концентрация молекул газа
 . (3.2.11.)
. (3.2.11.)
где k - постоянная Больцмана: (3.2.12.)
(3.2.12.)
Уравнение (3.2.6.) можно записать так: 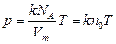 (3.2.6’.)
(3.2.6’.)
Пример 3.2.1. В баллоне объемом 10 л находится гелий под давлением 10 бар и при температуре 270С. После того, как из баллона было взято 10 г гелия, температура в баллоне понизилась до 170С. Определить давление газа, оставшегося в баллоне.

 Решение:
Решение:
 Для начального состояния уравнение Менделеева - Клапейрона имеет вид:
Для начального состояния уравнение Менделеева - Клапейрона имеет вид:  . Т.к. объем гелия в конечном состоянии будет таким же (ограничен объемом сосуда), то
. Т.к. объем гелия в конечном состоянии будет таким же (ограничен объемом сосуда), то 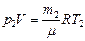 . Т.к.
. Т.к. 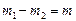 , то из данных уравнений найдем массы:
, то из данных уравнений найдем массы:  и
и  , получим
, получим 
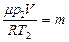 .
. 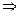
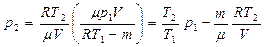
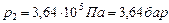
Ответ:  .
.
Пример 3.2.2. Найти массу киломоля смеси 25 г кислорода и 75 г азота.
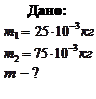
 Решение:
Решение:

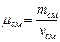 , где масса смеси равна сумме компонент смеси:
, где масса смеси равна сумме компонент смеси:  . Число киломолей смеси равно сумме киломолей отдельных газов:
. Число киломолей смеси равно сумме киломолей отдельных газов: 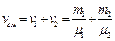 , т.к.
, т.к.  ,
,  , то
, то 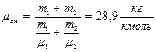
Ответ: 
Пример 3.2.3. Определить: 1) сколько молекул содержится в 1 мм3 воды? 2) какова масса молекулы воды? 3) считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр молекул.
1. .Т.к.
.Т.к. ,
,  , то
, то молекул.
молекул.
2. Масса одной молекулы:  .
.
3. Если молекулы плотно прилегают друг к другу, то можно считать, что на каждую молекулу приходится объем (кубическая ячейка):  , где
, где 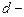 диаметр молекулы. Если разделить объем одного киломоля вещества на число молекул в киломоле (число Авогадро), то
диаметр молекулы. Если разделить объем одного киломоля вещества на число молекул в киломоле (число Авогадро), то  и
и  .
.
Пример 3.2.4. Какое количество кислорода выпустили из баллона емкостью 10 л, если при этом показания манометра на баллоне изменились от 14 до 17 ат, а температура понизилась от 270С до 70С?
|
|
|
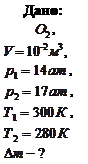
 Решение:
Решение:
 Масса выпущенного из баллона газа
Масса выпущенного из баллона газа  равна разности между начальной массой кислорода в баллоне и его конечной массой
равна разности между начальной массой кислорода в баллоне и его конечной массой  . Т.к. условия в баллоне не слишком отличаются от нормальных, газ можно считать идеальным. Для начального и конечного состояний газа в баллоне получим
. Т.к. условия в баллоне не слишком отличаются от нормальных, газ можно считать идеальным. Для начального и конечного состояний газа в баллоне получим  ,
, 
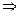
 .
.
Внимание: чтобы найти давление газа в баллоне, прибавим к показателям манометра величину атмосферного давления, равную 1 ат. Выразим в единицах СИ числовые значения величин:  ,
, ,
, 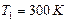 ,
, 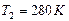 ,
,  ,
, 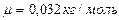 ,
,  . Получаем
. Получаем  .
.
Ответ:  .
.
Пример 3.2.5. Найти молярную массу воздуха, считая, что он состоит по массе из одной части кислорода и трех частей азота.

 Решение:
Решение:
 Свойствами идеального газа могут обладать не только химически однородные газы, но и газовые смеси. Чтобы применить уравнение состояния для газовой смеси, ей необходимо приписать некоторую, хотя и лишенную химического смысла, относительную молекулярную массу. Масса смеси в граммах, численно равная ей, представляет собой молярную массу
Свойствами идеального газа могут обладать не только химически однородные газы, но и газовые смеси. Чтобы применить уравнение состояния для газовой смеси, ей необходимо приписать некоторую, хотя и лишенную химического смысла, относительную молекулярную массу. Масса смеси в граммах, численно равная ей, представляет собой молярную массу  смеси. Величину
смеси. Величину  выбирают такой, чтобы она удовлетворяла уравнению газового состояния, записанному для смеси:
выбирают такой, чтобы она удовлетворяла уравнению газового состояния, записанному для смеси: 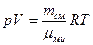 . Рассмотрим каждую из газовых компонент:
. Рассмотрим каждую из газовых компонент:  ,
,  , где
, где  и
и 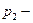 парциальные давления каждой компоненты. Для смеси справедлив закон Дальтона:
парциальные давления каждой компоненты. Для смеси справедлив закон Дальтона:  , откуда
, откуда  , а т.к.
, а т.к.  , то
, то  и
и  . Табличные значения
. Табличные значения  ,
,  , получаем
, получаем  .
.
Ответ: 
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 401; Нарушение авторских прав?; Мы поможем в написании вашей работы!