
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмотическое давление
|
|
|
|
Разбавленные растворы неэлектролитов.
Осмос (от греческого οςμος, толчок) - процесс самопроизвольного перехода растворителя в раствор через полупроницаемую перегородку. Давление p, которое нужно приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением.
Сосуд (осмометр) с раствором большой концентрации (С1) помещён в чашку с раствором меньшей концентрации (С2) 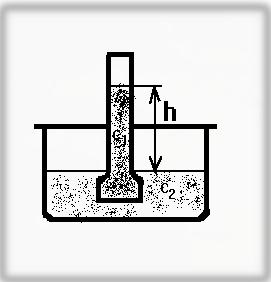
Осмометр имеет полупроницаемую перегородку, через которую могут проникать только молекулы растворителя, например, воды. В качестве полупроницаемой мембраны используют плёнку растительного или животного происхождения (например, плавательный пузырь рыб). Плёнку также можно синтезировать, если мембрану из пористого стекла или керамики обработать растворами солей:
2CuSO4 + K4 [Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4,
При этом поры становятся полупроницаемыми, так как образовавшаяся коллоидная плёнка из Cu2[Fe(CN)6] пропускает лишь воду, задерживая более крупные молекулы. Так как С1 > С2, то молекулы воды начнут диффундировать через полупроницаемую стенку, из раствора с меньшей концентрацией С2 в раствор с большей концентрацией С1.до выравнивания концентраций. При достижении равновесия установится определённая разница в уровнях растворов, избыточное давление, возникающее при этом, называется осмотическим давлением. Осмотическое давление определяется внешним давлением на раствор (величиной гидростатического давления столба жидкости высотой h), при котором диффузия воды через мембрану прекращается.
Растворы с равными осмотическими давлениями называются изотоническими. Гипертонический раствор имеет большее осмотическое давление, а гипотонический – меньшее относительно другого сравниваемого раствора.
|
|
|
Осмос играет важную роль в жизни живой природы, так как свойством полупроницаемости обладает большинство оболочек (тканей) животных и растительных организмов. Осмос является одной из причин поднятия воды по стеблю растений.
Голландский физикохимик Якоб-Генрик Вант-Гофф в 1886 году показал, что для разбавленных растворов неэлектролитов зависимость осмотического давления от концентрации и температуры может быть выражена исходя из уравнения Менделеева-Клапейрона
рV = nRT
Переносим объём в правую часть:
р = (n/V)RT
учитываем, что (n/V) = СМ, и получаем
р = СМRT
где
р, Па – осмотическое давление раствора,
СМ, моль/л – концентрация раствора,
n – число молей в объёме V,
R = 8, 314 (Дж/мольК) – универсальная газовая постоянная,
Т- абсолютная температура.
Закон Вант-Гоффа. описывает осмотическое давление
Осмотическое давление равно тому давлению, которое производило бы растворённое вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало бы объём, равный объёму раствора. Итак,
π = СМRT
Вант-Гофф рассмотрел процесс растворения только лишь как физическое явление, не учитывая природы растворённого вещества и растворителя, химизма растворения. Поэтому, закон Вант-Гоффа удовлетворительно выполняется только для предельно разбавленных и идеальных растворов. В этом случае осмотическое давление не зависит от природы компонентов и возрастает пропорционально концентрации растворённого вещества и температуре. Закон Вант- Гоффа позволяет определять молекулярную массу растворённых веществ, которые не переходят в газообразное состояние, но растовряются в том или ином растворителе (например, сахар в воде).
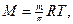 так как
так как 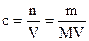 и, соответственно,
и, соответственно, 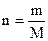
учитывая, что V = 1л = 1000мл,
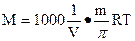
Для определения молярной массы растворённого вещества используют и другие свойства растворов, измерение упругости пара, понижение температуры замерзания и повышение температуры кипения, которые описываются законами Рауля. Число молей растворённого вещества берётся здесь на 1000г растворителя.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 531; Нарушение авторских прав?; Мы поможем в написании вашей работы!