
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория Пирсона
|
|
|
|
O O
При повышении основности шлака по мере присоединения ионов кислорода полимерные цепочки разрываются на более мелкие фрагменты, снижаются степень полимеризации n и, следовательно, вязкость шлака. Кроме того, с повышением основности шлака растет концентрация в его расплаве ионов кислорода, следовательно, усиливаются окислительные свойства. Таким образом, основные шлаки обладают меньшей вязкостью и большей окислительной способностью по сравнению с кислотными. Поэтому важна количественная характеристика кислотно-основных свойств шлаков.
За меру основности шлака принимают активность ионов кислорода в расплаве a(O2-). Поскольку она мала, удобнее пользоваться её показателем - отрицательным логарифмом: pO = - lg a(O2-). Кислородный показатель рО изменяется симбатно кислотности шлака. Чем ниже активность ионов кислорода, тем выше рО и кислотность шлака.
Измеряют кислородный показатель с помощью электродных датчиков или используя цветные индикаторы. Например, зеленый оксид хрома (Ш) Cr2O3 устойчив в кислых шлаках, а в основных, при низких рО, окисляется до желтого хромата CrO42-.
За нейтральный шлак принимают расплав чистых оксидов железа с соотношением:
i = [Fe3+] / ([Fe2+] + [Fe3+]); (9.8)
При введении в расплав основных оксидов растут активность ионов кислорода и концентрация [Fe3+]. Следовательно, основные шлаки имеют окислительный показатель i > 0,35. Кислым шлакам соответствует i < 0,35.
Шлаки могут обладать буферными свойствами. При введении в шлак оксидов кальция и кремния в молярном соотношении CaO:SiO2=1,306 шлак в широком интервале составов нейтрален, имеет окислительный показатель i @ 0,35. Состав такого шлака приблеженно может быть описан формулой: 2CaSiO3 + Ca2SiO4. В нем устанавливается следующее кислотно-основное равновесие:
|
|
|
SiO32- + O2- Û SiO44-; (9.9)
Буферный раствор по Льюису представляет собой смесь слабой кислоты SiO32- с сопряженным с ней основанием SiO44-. При добавлении в шлак основного оксида, эмитируемые им ионы О2- будут связываться в результате превращения метасиликата в ортосиликат, в результате концентрация ионов кислорода почти не изменится. При добавлении кислотного оксида, связывающего ионы кислорода, их концентрация сохранится постоянной за счет диссоциации SiO44-. Таким образом, буферный шлак поддерживает постоянную концентрацию ионов кислорода, следовательно имеет постоянные вязкость и окислительную способность. Буферные шлаки удобны для проведения технологических процессов, поэтому часто производят шихтовку шлаков оксидами кальция и кренмия в указаннов соотношении.
В 1963 г. Пирсон развил теорию Льюиса путем классификации кислот и оснований на “жесткие” и “мягкие”. В основе классификации Пирсона лежит представление о дативных связях. Рассмотрим образование дативной связи в сульфиде меди (П). За счет 2-х неспаренных 3 р -электронов серы и 2-х валентных электронов меди образуется обычная двойная s + p связь. Однако у меди остаются ещё 9 электронов на 3d-орбиталях, образующие 4 неподеленные электронные пары (на 5-ой орбитали располагается 1 электрон). В то же время у серы на валентном уровне имеются 5 вакантных 3d-орбиталей. Между ними могут образоваться 4 донорно-акцепторных связи согласно схеме:
s+p
Cu ===== S
3d:::: ¾®
дативная связь
Дативные связи являются по своей природе донорно-акцепторными p-типа. Отличие дативной связи от обычной донорно-акцепторной в том, что сдвиг электронов происходит в обратном направлении: от центрального атома к лиганду, от катиона-акцептора к аниону-донору. В дативном связывании катион проявляет донорные свойства, а анион предоставляет акцепторные орбитали. Дативные связи, как правило, имеют дробную кратность вследствие большого различия энергии орбиталей. То есть дативные связи слабее обычных валентных связей, но их вклад существенно повышает устойчивость соединений, снижает их растворимость и проявляется в других свойствах.
|
|
|
Пирсон назвал кислоты и основания Льюиса, способные к образованию дативных связей, “мягкими”, а неспособные к дативному взаимодействию - “жесткими”.
Согласно правилу Пирсона, “мягкие” кислоты образуют прочные соединения с “мягкими основаниями, а “жесткие” кислоты - с “жесткими основаниями”. Для соединения “мягких” кислот и оснований характерна высокая степень ковалентности связей, а для соединений “жестких” кислот и оснований характерны ионные связи. “Жесткая” частица с “мягкой” образуют соединения, неустойчивые к растворению, термическому разложению, действию различных реагентов и т.п.
К “мягким” кислотам относят катионы, имеющие неподеленные пары электронов на валентном уровне. Их 2 типа:
1. Катионы переходных металлов с числом d-электронов больше 6 (так как 5 электронов размещаются по одному на пяти d-орбиталях). Это Fe2+, Ni2+, катионы кобальта, меди, цинка и их аналогов по Периодической системе.
2. Катионы р -элементов больших периодов, которые имеют на валентном уровне полностью заполненную (n-1)d-оболочку с 5-ю неподеленными электронными парами. Это катионы олова, свинца, висмута, мыщьяка, сурьмы и др.
К “мягким” основаниям относят анионы и молекулярные лиганды, имеющие на валентном уровне вакантные p- орбитали. Это S2-, HS-, I-, CN- и СО. Два последних лиганда не имеют на валентном уровне d-орбиталей, но у них есть вакантные молекулярные орбитали p-типа.
Все остальные катионы и лиганды относят к “жестким”. “Жесткие” кислоты - это, в основном, катионы металлов главных подгрупп и первой половины вставных декад Периодической системы. Наиболее “жесткие” основания: О2-, ОН-, анионы кислородных кислот, оксигидрильные органические соединения с группой ¾ОН (спирты, карбоновые кислоты), кетоны, эфиры, амины и др.
Теория Пирсона объясняет некоторые закономерности в свойствах соединений. Например, в рядах галогенидов металлов, являющихся “мягкими” кислотами, от фторидов к йодидам понижаются растворимость и константы нестойкости комплексов. Тогда как у галогенидов “жестких” кислот устойчивость растет в обратном направлении: от йодидов к фторидам. Распределение катионов по группам в сероводородном методе качественного анализа, основанное на различиях в растворимости их сульфидов, соответствует классификации Пирсона: чем “мягче” катион-кислота, то есть чем больше у него неподеленных электронных пар, тем ниже растворимость сульфида.
|
|
|
Теория Пирсона объясняет также происхождение сульфидных руд. В природе, в виде минералов, встречаются только труднорастворимые сульфиды, образованные “мягкими” кислотами. Элементы, являющиеся “жёсткими” кислотами, в природе находятся только в виде простых и сложных оксидов, фторидов или хлоридов.
Лекция 11. Гидролитические равновесия в водных растворах солей. Особенности протекания реакций обмена в растворах электролитов. Буферные растворы
Гидролизом называют процессы разложения химических соединений в результате реакции с водой.
Гидролиз соли - это реакция, обратная процессу образования соли путем нейтрализации кислоты основанием.
нейтрализацияÞ
НА + МОН Û МА + Н2О.
к-та основание Ü гидролиз соль вода
Условие протекания реакций в растворах электролитов - образование малодиссоциированного соединения. Поэтому нейтрализация сильной кислоты щелочью протекает необратимо, обратный процесс - гидролиз - невозможен. Гидролизуются только соли, содержащие в своем составе ионы слабых электролитов: слабой кислоты или слабого основания. Отсюда следует правило составления уравнений гидролиза.
Записывают уравнение диссоциации соли, например:
NaCN à Na+ + CN-.
соль катион анион
основания кислоты
Определяют ион слабого электролита, который может гидролизоваться. В примере это анион CN -.
Составляют ионное уравнение гидролиза:
ион слабого + вода Û слабый + ион, оставшийся
электролита электролит от молекулы воды
В рассматриваемом примере:
|
|
|
CN- + H2O Û HCN + OH-.
анион вода слабая остаток
слабой кислота от воды
кислоты
Если требуется, то записывают молекулярное уравнение гидролиза, добавляя к ионам противоионы, в примере, катионы Na+.
NaCN + H2O à HCN + NaOH.
При решении задач молекулярное уравнение не требуется, так как расчеты равновесий в растворах электролитов ведут по ионным уравнениям реакций.
Ион слабого электролита в п.2 определяют по таблицам констант диссоциации. Ионов сильных кислот и оснований сравнительно немного, наиболее распространенные следует запомнить: NO3-, SO42-, Cl-, Br-, I-, ClO4 -, катионы Na+, K+и других щелочных металлов, а также Ba2+ и Sr2+. Перечисленные ионы не гидролизуются! Все остальные ионы, за редким исключением, образуют слабые электролиты и гидролизуются.
Гидролиз многозарядных ионов протекает ступенчато. Составим уравнение гидролиза сульфида натрия.
1. Диссоциация соли: Na2S à 2Na+ + S2-.
2. Гидролизуется анион слабой кислоты S2 -.
3. Ионные уравнения гидролиза:
S2- + H2O Û HS- + OH- (1-я ступень)
HS- + H2O Û H2S + OH- (2-я ступень)
В зависимости от состава соли различают следующие типы гидролиза.
Гидролиз соли, образованной сильным основанием и слабой кислотой. Гидролизуется анион слабой кислоты.
А- + Н2О Û НА + ОН-.
В растворе появляются ионы ОН-, поэтому среда - щелочная, рН > 7.
Гидролиз соли, образованной слабым основанием и сильной кислотой. Гидролизуется катион слабого основания.
М+ + Н2О à МОН + Н+.
В растворе появляются ионы Н+, поэтому среда - кислая, рН < 7.
Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону.
М+ + А- + Н2О à МОН + НА
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то есть её константа диссоциации больше, то среда - слабокислая. Если сильнее основание, то среда - слабощелочная.
Количественные характеристики гидролиза - константа и степень гидролиза. Рассмотрим их расчет для первых двух типов гидролиза на примере гидролиза Na2CO3 по аниону. Все количественные расчеты проводят по ионным уравнениям.
1-ая ступень: СО32-+ Н2О à НСО3- + ОН-;
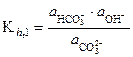 , (26)
, (26)
так как  = 1 (стандартное состояние). Путем подстановки в уравнение (26) следующих выражений:
= 1 (стандартное состояние). Путем подстановки в уравнение (26) следующих выражений:
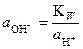
и
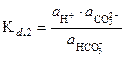
получаем:
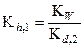 (27)
(27)
где K h, 1 - константа гидролиза карбонат-иона по первой ступени, K w - ионное произведение воды, равное 10-14 при 298 К, K d, 2 - константа диссоциации угольной кислоты по второй ступени.
2-ая ступень гидролиза: НСО3- + Н2О Û Н2СО3 + ОН-;
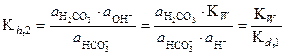 (28)
(28)
Если гидролиз протекает по катиону, то получаем аналогичные уравнения. Константы диссоциации гидроксокомплексов металлов называют ступенчатыми константами нестойкости, их находят в справочнике в таблице констант нестойкости гидроксокомплексов. Рассчитаем численные значения констант гидролиза для карбонат-иона.
K h, 1= 10-14 / 4,69×10-11 = 2,13×10-4;
K h ,2 = 10-14 / 4,45×10-7 = 2,25×10-8.
Аналогичные количественные соотношения наблюдаются и при гидролизе большинства других ионов. Выводы:
Так как K h малы, гидролиз солей, образованных одним слабым электролитом, протекает в малой степени.
Вследствие того, что K h, 1 >> K h, 2, гидролиз многозарядных ионов в основном проходит по первой ступени, высшими ступенями гидролиза в расчетах можно пренебрегать.
Степенью гидролиза (аналогично степени диссоциации) называют отношение числа гидролизованных ионов к общему числу ионов слабого электролита в растворе. Для гидролиза Na2CO3:
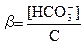 (29)
(29)
где С - концентрация соды в моль/л.
Согласно уравнению гидролиза
[НСО3-] = [ОН - ] = bС, а [СО32-] = (1-b)С.
После подстановки в уравнение (26) получаем:
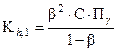 , (30)
, (30)
где 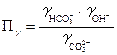 - произведение коэффициентов активности.
- произведение коэффициентов активности.
Если b << 1, то пренебрегаем её величиной в знаменателе дроби и получаем:
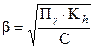 (31)
(31)
Если bзначительна, её находят решением квадратного уравнения (30).
Для расчета рН в растворах солей, гидролизующихся по аниону, в формуле (26) произведем следующие преобразования: [НСО3-] = [ОН-] и [СО32-] = С.
Получаем:
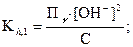 .
.
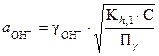 (32)
(32)
pOH = -lg a (OH-)и рН = 14 - рОН.
Если соль гидролизуется по катиону, то среда в растворе кислая. Поэтому вычисляют a (H+), для расчета которой можно вывести формулу, полностью аналогичную (32).
Fe3+ + H2O Û Fe(OH)2+ + H+;
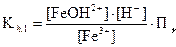 ,
,
где 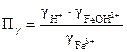
Считаем, что [Fe3 + ] @ Cи [FeOH2+] = [H+]. Тогда:
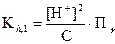 .
.
Отсюда следует, что
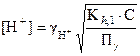 (33)
(33)
Рассмотрим теперь гидролиз соли, образованной двумя слабыми электролитами (тип 3).
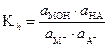 (34)
(34)
Домножим уравнение на  .
.
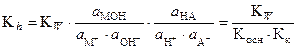 , (35)
, (35)
где Kосни Kк - константы диссоциации основания и кислоты, образующих соль. Формула (35) служит для расчета константы гидролиза по табличным значениям констант диссоциации. При близких значениях констант гидролиза обоих ионов [МОН] @ [НА] = b×С, а [М+] @ [А-] = (1-b)×С. После подстановки в (34) получаем:
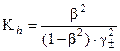 (36)
(36)
Степень гидролиза вычисляют решением уравнения (36), где g± - среднеионный коэффициент активности гидролизующейся соли:
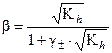 (37)
(37)
Константа и степень гидролиза у соли, образованной двумя слабыми электролитами, значительно выше, чем у солей, образованных одним слабым электролитом. Если в результате гидролиза образуются газ или осадок, то, согласно принципу Ле-Шателье, гидролиз усиливается. В этом случае соль полностью разлагается водой. Например, карбонат железа (3+) или сульфид алюминия не выпадают в осадок из водного раствора ввиду полного гидролиза по уравнениям:
Fe2(CO3)3 + 3H2O à 2Fe(OH)3¯ + 3CO2;
Al2S3 + 6H2O à 2Al(OH)3¯ + 3H2S.
Отношение активностей ионов Н+и ОН - в растворе соли определяется относительной силой кислоты и основания. Согласно формулам (32) и (33):
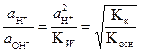 ,
,
где KкиKосн - константы диссоциации слабых кислоты и основания, которыми образована соль. Отсюда следует, что при 298 К (K W = 10-14):
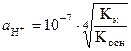 (38)
(38)
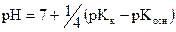 (39)
(39)
Формулы (38) и (39) точны при близких значениях степени гидролиза соли по катиону и по аниону.
Все выведенные формулы для расчета степени гидролиза и рН в растворах солей справедливы для систем соль - вода без добавок кислот и щелочей.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2659; Нарушение авторских прав?; Мы поможем в написании вашей работы!