
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В отсутствие одноименного иона
|
|
|
|
Растворимость в многокомпонентной системе
Одноименными называют ионы, входящие в состав рассматриваемого труднорастворимого соединения. Если таковые в многокомпонентном растворе отсутствуют, то расчет растворимости ведут также по формуле (53), но с учетом ионной силы раствора. Вкладом труднорастворимого соединения в ионную силу пренебрегают, если его растворимость более, чем в 100 раз ниже концентрации других компонентов раствора. Ионную силу вычисляют по формуле (8), а коэффициент активности по (6) или (7), подставляя в последние вместо квадрата заряда иона модуль произведения зарядов ионов, образующихся при растворении труднорастворимой соли.
Следует запомнить, что с ростом ионной силы g± при не слишком высоких концентрациях электролита понижается, а растворимость увеличивается.
в) Растворимость в многокомпонентной системе с одноимёнными ионами.
Рассмотрим расчет растворимости соли Мn+Аn - в системе, содержащей хорошо растворимую соль M¢Аn¢с одноименным анионом. Пример такой системы: PbCl2 - NaCl - H2O. В этом случае используют формулу (50). Катионы Mz + переходят в раствор только из осадка, поэтому их концентрация определена растворимостью: [Mz+] = n+S. Однако концентрация анионов в растворе складывается из двух составляющих, обусловленных, во-первых, растворимостью труднорастворимой соли n-S, и, во-вторых, концентрацией соли М¢An¢, которую обозначим n¢С¢. После подстановки в формулу (50) получаем:
L = (n+S)n+(n-S + n¢C¢)n-×g±n. (54)
Растворимость находят путем решения степенного уравнения (54). Если растворимость меньше концентрации соли с одноименным ионом в 100 и более раз, то есть n-S < 0,01n¢C¢, то возможны упрощения. Во-первых пренебрегают в сумме меньшим слагаемым и получают:
|
|
|
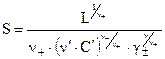 (55)
(55)
Во-вторых, при расчете коэффициента активности пренебрегают вкладом труднорастворимой соли в ионную силу. Аналогично вычисляют растворимость в присутствии одноименного катиона. Следует запомнить, что растворимость в присутствии одноименных ионов всегда понижается, так как их концентрация в (55) стоит в знаменателе дроби.
д) Условия образования осадков.
Формула (50) описывает состояние равновесия, в котором в системе отсутствуют потоки вещества. Если произведение концентраций ионов, образующих труднорастворимую соль, выше равновесного значения, то есть правая часть в формуле (50) больше левой, то в системе будет происходить образование осадка. При противоположном знаке неравенства осадок будет растворяться.
При очистке кислотных стоков путем нейтрализации выделяют осадки гидроксидов металлов. Значение рН, при котором из данного раствора начинает выпадать осадок гидроксида, называют рН гидратообразования. Для расчета этой характеристики используют следующие формулы:
М(ОН) z (т) Û Мz+(р-р) + zOH-(р-р);
L = [Mz+][OH-]z×g±z+1. (57)
Из формулы (57) находят концентрацию ионов гидроксила, а затем рН гидратообразования.
связей в продуктах реакции.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 337; Нарушение авторских прав?; Мы поможем в написании вашей работы!