
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродные потенциалы и электродвижущие силы
Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в раствор. При этом электроны, в избытке оставшиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными ионами и поверхностью металла. В результате в системе устанавливается подвижное равновесие:
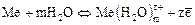
где z– число электронов, принимающих участие в процессе.
На границе металл-раствор возникает двойной электрический слой, характеризующийся определенным скачком потенциала – электродным потенциалом. Электродные потенциалы зависят от природы металла, концентрации, температуры и т. д. Абсолютное значение электродных потенциалов измерить невозможно, поэтому определяют относительные электродные потенциалы в стандартных условиях – E0.
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью) 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при Т=298 К и р(H2)=1,013×105 Па, условно принимают равным 0.
Значения стандартных электродных потенциалов Е0 сведены в таблицу. Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получаем так называемый ряд «напряжений металлов». Положение металла в этом ряду характеризует его восстановительную способность.
Электрод, на котором идет процесс восстановления, называется катодом
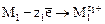
Электрод, на котором идет процесс окисления, называется анодом
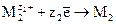
Объединив уравнения электродных процессов, получим суммароное уравнение реакции
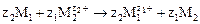
Устройство, в котором протекает окислительно-восстановительная реакция, а окислитель и восстановитель пространственно разделены называется гальваническим элементом. Переход электронов от восстановителя к окислителю происходит по внешней цепи.
Схему гальванического элемента, состоящего из двух ионно-металлических электродов записывают так:
М1êэлектролит1êêэлектролит2êМ2
причем М1 – это металл анода, а М2 – катода.
Напряжение на гальваническом элементе, соответствующие бесконечно малому току во внешней цепи, называется электродвижущей силой (ЭДС) гальванического элемента, обозначим ее DЕ.
ЭДС гальванического элемента определяется по формуле:
DЕ=ЕК–ЕА,
где ЕК и ЕА – потенциалы катода и анода. Зависимость равновесного электродного потенциала от концентрации и температуры описывается уравнением Нернста, которое имеет вид:
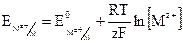 ,
,
где 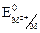 стандартный электродный потенциал металла; R=8,31 Дж/(моль×К) – универсальная газовая постоянная; Т–абсолютная температура, К; F=96500 А×с – постоянная Фарадея; [Mz+] – молярная концентрация ионов металла, моль/л.
стандартный электродный потенциал металла; R=8,31 Дж/(моль×К) – универсальная газовая постоянная; Т–абсолютная температура, К; F=96500 А×с – постоянная Фарадея; [Mz+] – молярная концентрация ионов металла, моль/л.
При температуре 298 К уравнение Нернста принимает вид:
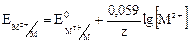 .
.
Так как потенциал электрода зависит от концентрации, ЭДС гальванического элемента, составленных из однотипных электродов (один и тот же металл в растворе одной и той же соли) с разными концентрациями растворов, будет отличен от нуля. Такой гальванический элемент называется концентрационным. Анодом в нем является электрод с меньшей концентрацией потенциал-определяющих ионов.
|
Дата добавления: 2014-01-07; Просмотров: 182; Нарушение авторских прав?; Мы поможем в написании вашей работы!