
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
Будем снова анализировать обратимый цикл Карно без ограничения на рабочее тело, учитывая эквивалентность термодинамической и идеально-газовой температурных шкал. При этом с учетом замечания о модулях количества теплоты, для кпд цикла Карно имеем
 , (5.4.1)
, (5.4.1)
или, снимая модуль,
 . (5.4.2)
. (5.4.2)
Отношение количества теплоты к температуре, при которой эта теплота передана, называется приведенным количеством теплоты. Физический смысл выражения (5.4.2) состоит в том, сумма приведенных теплот в цикле Карно равна нулю.
 Рассмотрим теперь произвольный обратимый цикл (рис. 5.4.1).
Рассмотрим теперь произвольный обратимый цикл (рис. 5.4.1).
Разобьем цикл адиабатами и соединим их участками изотерм. Таким образом, получим разбиение исходного цикла на  циклов Карно. Теперь, чтобы найти приведенное количество теплоты, нужно сложить приведенные количества теплот в этих циклах. Чем чаще проводятся адиабаты, тем ближе сумма
циклов Карно. Теперь, чтобы найти приведенное количество теплоты, нужно сложить приведенные количества теплот в этих циклах. Чем чаще проводятся адиабаты, тем ближе сумма  к значению приведенного количества теплоты в рассматриваемом цикле. В переделе бесконечно близких адиабат суммарное приведенное количество теплоты равно интегралу элементарного приведенного количества теплоты
к значению приведенного количества теплоты в рассматриваемом цикле. В переделе бесконечно близких адиабат суммарное приведенное количество теплоты равно интегралу элементарного приведенного количества теплоты 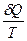 по замкнутому контуру. Так как в каждом из циклов Карно приведенное количество теплоты равно нулю, то и указанный интеграл равен нулю:
по замкнутому контуру. Так как в каждом из циклов Карно приведенное количество теплоты равно нулю, то и указанный интеграл равен нулю:
 . (5.4.3)
. (5.4.3)
Итак, в обратимом циклическом процессе интеграл по замкнутому контуру от приведенного количества теплоты равен нулю. Из математического анализа известно, что в этом случае под знаком интеграла стоит дифференциал некоторой функции, не зависящей от пути перехода система из одного состояния в другое. Эта функция зависит только от параметров состояния.
Функция состояния, дифференциал которой численно равен элементарному приведенному количеству теплоты в обратимом процессе, называет энтропией:
|
|
|
 . (5.4.4)
. (5.4.4)
На основании (5.4.3) и термодинамического определения энтропии можно заключить, что в обратимом процессе дифференциально малое приращение энтропии равно нулю
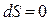 . (5.4.5)
. (5.4.5)
Можно определить и изменение энтропии в обратимом процессе при переходе системы из состояния 1 в состояние 2:
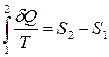 . (5.4.6)
. (5.4.6)
Как вычислить изменение энтропии в необратимом процессе? Поскольку энтропия – функция состояния, ее изменение не зависит от процесса, по которому осуществлен переход. Таким образом, нужно заменить реальный необратимый процесс обратимым с теми же начальным и конечным состояниями и определить изменение энтропии в этом процессе, которое будет равно изменению энтропии при переходе из состояния 1 в состояние 2 необратимым образом.
Рассмотрим теперь цикл, включающий неравновесный процесс, то есть необратимый цикл. Предположим, циклический процесс на участке 1-2 необратим, а на участке 2-1 обратим. Как было доказано во второй теореме Карно кпд необратимого цикла всегда меньше кпд обратимого цикла, следовательно  . Значит сумма приведенных теплот в случае необратимого цикла, при температурах нагревателя и холодильника
. Значит сумма приведенных теплот в случае необратимого цикла, при температурах нагревателя и холодильника  и
и  соответственно, меньше нуля:
соответственно, меньше нуля:
 . (5.4.7)
. (5.4.7)
Рассмотрим теперь произвольный необратимый цикл (график процесса не изображаем, так как неравновесное состояние невозможно изобразить на диаграммах состояния: ему не соответствуют значения параметров состояния, относящиеся ко всей системе в целом). Разобьем его на бесконечно малые циклы. Среди этих циклов могут оказаться как равновесные, для каждого из которых приведенное количество теплоты равно нулю, так и неравновесные с приведенной теплотой, меньшей нуля. Таким образом, суммарное приведенное количество теплоты за рассматриваемый необратимый цикл меньше нуля.
 (5.4.8)
(5.4.8)
Объединение условий (5.4.3) и (5.4.8) дает неравенство Клаузиуса для приведенного количества теплоты в циклическом процессе
|
|
|
 . (5.4.9)
. (5.4.9)
Знак равенства соответствует обратимому процессу, знак «меньше» - необратимому процессу.
Рассмотрим вопрос о направлении процессов в изолированных системах. Пусть изолированная система самопроизвольно перешла из состояния 1 в состояние 2 в результате неравновесного процесса. Для того чтобы осуществить возврат системы в первоначальное состояние (без изменения в окружающих телах) необходимо реализовать равновесный процесс, но для этого придется снять условие изолированности. Тогда интеграл приведенного количества теплоты по замкнутому контуру можно представить в виде суммы двух интегралов, соответствующих приведенному количеству теплоты, переданному изолированной системе в неравновесном процессе и приведенному количеству теплоты, переданному неизолированной системе в равновесном процессе:
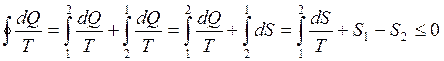 (5.4.10)
(5.4.10)
Первый интеграл в этой сумме равен нулю, так как система изолирована, и теплота ей не сообщается; второй интеграл, согласно (5.4.6), равен изменению энтропии при переходе из состояния 2 в состояние 1 – (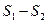 ). Весь интеграл по замкнутому контуру 121, согласно неравенству Клаузиуса (5.4.8), меньше нуля, так как один из процессов, образующих цикл, необратим. Следовательно,
). Весь интеграл по замкнутому контуру 121, согласно неравенству Клаузиуса (5.4.8), меньше нуля, так как один из процессов, образующих цикл, необратим. Следовательно,
 . (5.4.11)
. (5.4.11)
Таким образом если рассмотрим не замкнутый адиабатический процесс то из неравенства Клаузиуса следует что, энтропия адиабатически изолированной системы не уменьшается. Она остается неизменной в равновесных процессах и увеличивается в неравновесных:
 (5.4.12)
(5.4.12)
т.е. энтропия адиабатически изолированной системы может только возрастать (если есть необратимые процессы), или оставаться неизменной (если все процессы обратимые). – это закон возрастания энтропии
Выражение (5.4.12) является количественной формулировкой второго начала термодинамики. Как говорилось выше, второе начало термодинамики говорит о направлении процессов в изолированных системах. Известно, что в изолированных системах процессы идут в направлении установления термодинамического равновесия. Таким образом, в равновесии энтропия изолированной системы принимает максимальное значение из всех возможных. Очевидно, что на основании этого факта можно установить микроскопический смысл энтропии. Пока можно изобразить макроскопический критерий эволюции изолированных систем графически (рис.5.4.2).
|
|
|
Первое и второе начала термодинамики для равновесных процессов можно объединить в одно выражение – термодинамическое неравенство:
 . (5.4.13)
. (5.4.13)
 В виде тождества оно справедливо для равновесных процессов в любых термодинамических системах, так как в нем не использовано никаких параметров конкретных моделей системы. Знак неравенства соответствует соотношению между термодинамическими величинами в неравновесных процессах в различных системах.
В виде тождества оно справедливо для равновесных процессов в любых термодинамических системах, так как в нем не использовано никаких параметров конкретных моделей системы. Знак неравенства соответствует соотношению между термодинамическими величинами в неравновесных процессах в различных системах.
Вне зависимости от свойств термодинамической системы в адиабатном процессе система не обменивается энергией с окружающей средой  , следовательно, и дифференциал энтропии в этом процессе равен нулю (по определению 5.4.4). В адиабатном процессе энтропия сохраняется, и этот процесс можно рассматривать как изоэнтропийный.
, следовательно, и дифференциал энтропии в этом процессе равен нулю (по определению 5.4.4). В адиабатном процессе энтропия сохраняется, и этот процесс можно рассматривать как изоэнтропийный.
Идеальный цикл удобно изобразить в координатах (S,T), как это сделано на рис.5.4.3.
 Вычислим коэффициент полезного действия идеальной машины Карно. Теплота
Вычислим коэффициент полезного действия идеальной машины Карно. Теплота  сообщается на участке 1-2
сообщается на участке 1-2
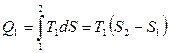 (5.4.14)
(5.4.14)
и отдается  на изотерме 3-4:
на изотерме 3-4:
 . (5.4.15)
. (5.4.15)
Тогда для кпд получаем:
 ,(5.4.16)
,(5.4.16)
где учтены равенства энтропии в состояниях 1 и 4, 2 и 3 соответственно. Таким образом, известное уже соотношение получено путем несколько иных рассуждений.
Представление графика процесса в координатах (S,T) позволяет численно определить количество теплоты, переданное или отданное системой в течение процесса. Это количество теплоты численно равно площади под графиком функции T (S) (рис.5.4.4).
Из рис. 5.4.3. так же видно, что изменение энтропии рабочего тела равно нулю. Как изменяется при этом энтропия окружающей среды? Изменение энтропии окружающей среды складывается из энтропии отобранной у среды и отданной в среду:

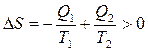 . (5.4.17)
. (5.4.17)
Таким образом, даже обратимая тепловая машина за каждый цикл производит не только работу, но и энтропию. Энтропия системы, включающей рабочее тело и среду, увеличивается.
|
|
|
Вычислим изменение энтропии в некоторых квазиравновесных процессах.
Рассмотрим квазиравновесные процессы плавления и кристаллизации. Эти процессы можно считать таковыми, если они идут бесконечно медленно, так, что температура системы на бесконечно малую величину отличается от температуры плавления и можно считать, что процесс идет при постоянной температуре. Поэтому можно использовать термодинамическое определение энтропии (5.4.4) и ее изменение определить как
 , (5.4.18)
, (5.4.18)
где  - удельная теплота кристаллизации.
- удельная теплота кристаллизации.
В (5.4.18) знак «+» соответствует процессу плавления, «‑» - кристаллизации. Таким образом, в процессе кристаллизации энтропия системы уменьшается, однако данный факт не противоречит второму началу термодинамики, поскольку рассматриваемая система не изолирована.
Найдем общее выражение для определения изменения энтропии идеального газа в обратимом процессе. В термодинамическом тождестве (5.4.13) явно зададим вид дифференциала внутренней энергии идеального газа и уравнение его состояния (1.2.13).
 . (5.4.20)
. (5.4.20)
Откуда для дифференциала энтропии получаем
 . (5.4.21)
. (5.4.21)
Когда изменяется и температура, и давление идеального газа необходимо использовать выражение (5.4.21). Интегрирование последнего выражения приводит к соотношению для вычисления изменения энтропии идеального газа в произвольном обратимом процессе:
 . (5.4.24)
. (5.4.24)
Если обратимый процесс является адиабатным (т.е. dQ= 0), то для него dS= 0 и, значит S=Const. Поэтому адиабатный процесс является изоэнтропийным процессом.
Рассмотрим использование необратимый процесс расширения в пустоту идеального газа. Расширение газа в пустоту всегда является необратимым процессом. В таком процессе работа не совершается, теплота газу не передается, внутренняя энергия газа остается постоянной, температура не изменяется. Заменим расширение газа в пустоту изотермическим процессом, с теми же начальным и конечным состояниями. Изменение энтропии при обратимом изотермическом процессе, на основании (5.4.22) записывается в виде
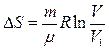 . (5.4.26)
. (5.4.26)
В обратимом изотермическом процессе газу передается некоторое количество теплоты, объем увеличивается, и изменение энтропии больше нуля.
Изменение энтропии в необратимом, самопроизвольно идущем в одном направлении, процессе расширения газа в пустоту тоже определяется соотношением (5.4.26), а значит больше нуля. Однако система замкнута, так как не обменивается с окружением ни энергией, ни частицами. Таким образом, в необратимом процессе расширения газа в пустоту в замкнутой системе энтропия производилась, генерировалась. Следовательно, энтропия замкнутой системы не сохраняется, в отличие от такой функции состояния как внутренняя энергия.
На основе понятия энтропии и неравенства Клаузиуса можно сформулировать 2-е начало термодинамики следующим образом: “Самопроизвольно в замкнутой системе термодинамические процессы идут таким образом, что энтропия остается постоянной в обратимых процессах и возрастает в необратимых” (формулировка Больцмана - Планка).
Итак, термодинамические процессы даже в замкнутой системе направлены во времени, и необходимо говорить об эволюции такой системы. Второе начало термодинамики в формулировке Больцмана - Планка является критерием эволюции замкнутых систем. В них осуществляется переход от упорядоченного состояния к максимально хаотическому состоянию термодинамического равновесия, в котором энтропия максимальна. Критерий эволюции замкнутых систем графически представлен на рис. 5.4.2
Сформулированный критерий эволюции Больцман применил ко всей Вселенной в целом, тем самым, рассматривая ее как замкнутую систему, и пришел к следующему критерию эволюции Вселенной. Вселенная, как термодинамическая система, эволюционирует к состоянию термодинамического равновесия, то есть к состоянию, в котором отсутствуют распределение температуры, макроскопические потоки. Такое состояние эквивалентно равновесному состоянию идеального газа и было названо тепловой смертью Вселенной.
Некоторые факты подтверждают этот вывод, например, скалы разрушаются самопроизвольно, прекратилось вращение Луны вокруг оси, замедляется и вращение Земли вокруг своей оси и т.д. Представления о тепловой смерти Вселенной приводят в мировоззренческий тупик, поскольку в такой эволюции наблюдаемый порядок во Вселенной не может появиться. Как возникло упорядоченное движение планет? Почему в процессе развития общества происходит все большее структурирование? Почему биологическая эволюция на Земле идет в сторону усложнения структур? Кто-то создал порядок, дал толчок эволюции? Современная термодинамика нашла ответы на эти вопросы, и к их рассмотрению мы еще обратимся, а пока проанализируем другой парадокс, следующий из второго начала термодинамики.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1174; Нарушение авторских прав?; Мы поможем в написании вашей работы!