
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процессы, протекающие с выделением теплоты, называются экзотермическими, а идущие с поглощением теплоты -эндотермическими
|
|
|
|
Лекция 11. Тепловой эффект реакции. Закон Гесса и следствия из него. Теплоты образования, сгорания, растворения, нейтрализации. Теплотворная способность. Зависимость теплового эффекта от температуры. Теплота фазовых превращений.
11.1 Тепловой эффект реакции.
11.2 Закон Гесса.
11.3 Теплота образования.
11.4 Теплота сгорания. Теплотворная способность топлива.
11.5 Теплота растворения.
11.6 Теплота нейтрализации.
11.7 Следствия из закона Гесса.
11.8 Зависимость теплового эффекта от температуры.
11.9 Теплота фазовых превращений.
11.1. В зависимости от природы системы (исходных веществ и продуктов реакции) химический процесс в ней сопровождается поглощением или выделением теплоты.
Уравнения реакций, учитывающие тепловые эффекты, называются
термохимическими, например,
2Н2(г)+О2(г) ↔ 2Н2О(г)+ 476 кДж
Тепловой эффект реакции необходимо характеризовать не только абсолютной величиной, но и знаком. Исторически сложились две системы отсчета: термохимическая и термодинамическая. В первой - знак теплового эффекта экзотермической реакции считается положительным (экзо- наружу). Эндотермические реакции сопровождаются отрицательным тепловым эффектом, теплота поглощается системой (эндо- внутрь). В термодинамике принята обратная система знаков, т.е. теплота, поглощаемая системой, считается положительной, а теплота, отданная системой в окружающую среду, - отрицательной. В термодинамической системе тепловой эффект реакции отождествляется с изменением энтальпии системы (если процесс протекает при постоянном давлении). При записи термохимического уравнения в этой системе тепловой эффект не включается в уравнение, а записывается рядом.
|
|
|
2Н2(г)+О2(г) ↔ 2Н2О(г), ∆Н= - 476 кДж
В дальнейшем будем придерживаться термодинамической системы знаков и полагать, что тепловой эффект эндотермической реакции связан с возрастанием энтальпии системы (∆Н >0), а экзотермической - с ее уменьшением (∆Н <0).
Различают изобарный и изохорный тепловые эффекты реакций (в зависимости от условий протекания процесса).
Изобарным тепловым эффектом реакции Qр называют теплоту химического процесса, протекающего при Р=const и равенстве температур исходного Т1 и конечного Т2 состояний системы Т1 = Т2.
Изохорным тепловым эффектом реакции Qv называют теплоту химического процесса, протекающего при V = соnst и Т1 = Т2.
Несмотря на то, что при химических процессах в системе Т=const, в ней обязательно происходит изменение внутренней энергии, хотя бы за счет изменения химической составляющей, связанной с изменениями строения веществ системы, происходящими при реакции. Отсюда следует, что изохорный тепловой эффект реакции, подобно теплоте изохорического процесса термохимической системы (см.2.14), равен изменению внутренней энергии системы
Qv=∆U (2.27)
А изобарный тепловой эффект, подобно теплоте изобарического процесса
термохимической системы (см.2.16,2.23) равен изменению энтальпии системы:
Qp=∆H (2.28)
Среди факторов, влияющих на тепловой эффект реакции, особое значение имеют массы реагирующих веществ, их агрегатные состояния, температура и давление. Для упрощения расчетов и в целях стандартизации введено понятие стандартного теплового эффекта реакции, а именно:
стандартным тепловым эффектом реакции называется теплота химического процесса, протекающего в стандартных условиях (298 К, 101325 Па) с образованием 1 моль продукта реакции.
Как следует из определения, стандартизация охватывает лишь изобарные тепловые эффекты и не касается тепловых эффектов процессов, идущих с образованием нескольких веществ.
|
|
|
Стандартные тепловые эффекты приводятся в специальных справочниках в форме теплот образования, теплот сгорания, теплот растворения и т.д.
11.2 Из (2.27, 2.28) следует, что тепловой эффект реакции, будучи теплотой процесса, протекающего при конкретных (фиксированных) условиях Р=const или V=const и равенства температур исходного и конечного состояний системы, обладает свойствами функции состояния.
Это значит, что тепловой эффект реакции зависит от исходного и конечного состояний системы и не зависит от промежуточных состояний. Такой вывод, являющийся следствием первого закона термодинамики, был сделан Гессом на основании анализа экспериментальных данных и получил название закона Гесса:
тепловой эффект химической реакции не зависит от пути реакции, т.е. от промежуточных стадий, а определяется только родом начальных и конечных веществ и их состоянием.
Закон Гесса имеет большое практическое и теоретическое значение. С его помощью можно узнать тепловой эффект любой реакции, не производя для этого непосредственных измерений. В некоторых случаях им можно пользоваться для определения тепловых эффектов реакций, которые невозможно проводить в «чистом» виде, так как им всегда сопутствуют побочные явления, мешающие проведению измерений.
Закон Гесса можно проиллюстрировать схемой
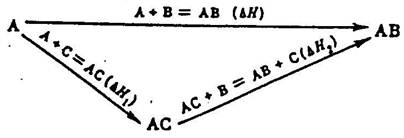
Здесь образование соединения АВ представлено двумя путями: непосредственным синтезом из компонентов (∆Н) или через стадию образования промежуточного соединения АС (∆Н1), которое, реагируя с В (∆Н2), дает тот же конечный продукт. В соответствии с законом Гесса тепловой эффект прямого синтеза АВ равен сумме тепловых эффектов реакций с участием промежуточного продукта АС, т.е. ∆Н=∆Н1+∆Н2
Проиллюстрируем закон Гесса на примере реакции сгорания метана:
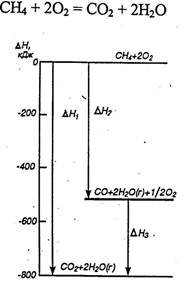 ∆Н1=-802,34 кДж
∆Н1=-802,34 кДж
Эту же реакцию можно провести через стадию образования СО:
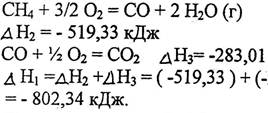
Рис. 2.6. Энтальпийная диаграмма сгорания метана
Как видно, тепловой эффект реакции, протекающей по двум путям, одинаков. Закон Гесса хорошо иллюстрируется с помощью энтальпийных диаграмм (рис.2.6).
Надо отметить, что из закона Гесса следует, что термохимические уравнения можно складывать, вычитать и умножать на численные множители.
|
|
|
11.3. В связи с необходимостью производить различные расчеты и невозможностью определения абсолютного значения энтальпии за начальную точку отсчета энтальпии веществ принята энтальпия простых веществ (т.е. она равна нулю), находящихся при стандартных условиях в устойчивых агрегатных состояниях. Например, газообразный хлор, жидкая ртуть, кристаллический иод, газообразный кислород, кристаллический алюминий, графит, жидкий бром и т.п. На основании этого в качестве характеристик энергий других веществ служат соответствующие
изменения энтальпий, происходящие при образовании их из простых веществ - теплоты образования.
Теплотой (энтальпией) образования называется тепловой эффект реакции образования 1 моль вещества из простых веществ при стандартных условиях (298 К, 101325 Па).
Стандартные энтальпии образования обозначаются ∆Н0обр.В. Значения их приведены в справочниках.
11.4. Известно, что большинство органических веществ при сгорании образуют СО2 и Н2О. Следовательно, если в качестве начальной точки отсчета принять энтальпию продуктов горения (СО2 и Н2О), то для термодинамических расчетов так называемых органических реакций могут быть использованы соответствующие изменения энтальпии, происходящие при сгорании веществ - теплоты сгорания:
- теплотой (этальпией) сгорания называется тепловой эффект реакции оксидирования 1 моль вещества газообразным кислородом до высших оксидов при постоянном давлении и равных температурах исходного и конечного состояний системы (Т1 = Т2).
Определяют теплоту сгорания сожжением испытуемого вещества в специальном контейнере - калориметрической бомбе - в избытке газообразного кислорода.
Стандартная теплота сгорания определяется при стандартных условиях. Если нет дополнительных указаний, то агрегатные состояния исходных веществ и продуктов горения считаются такими, каковы их устойчивые состояния при стандартных условиях.
C2H6О(ж) + 4О2 (г) = 3СО2(г) + 3Н2О (ж) ∆Н = 1789,8кДж
Для тепловой характеристики топлива используется обычно термин «теплотворная способность», характеризующий количество теплоты, выделяемой единицей массы вещества при полном его сгорании. Теплотворная способность топлива определяется количеством теплоты, выделяющейся при полном сгорании 1 кг топлива.
|
|
|
11.5. Большое значение для химических технологий имеет процесс образования растворов. Как правило, он сопровождается тепловым эффектом, зависящим от многих факторов: температуры, давления, природы растворителя и растворяемого вещества, концентрации образующегося раствора и т.д. Поэтому вводят ограничения, в зависимости от которых различают несколько видов теплот растворения. Чаще всего теплоту растворения относят к раствору данной концентрации, образовавшемуся смешением растворяемого вещества с чистым растворителем при постоянном давлении и равенстве температур исходного и конечного состояния системы (Т1 = Т2) в расчете на 1 моль растворяемого вещества и называют интегральной теплотой растворения (∆Нр). Если получают бесконечно разбавленный раствор (с —> 0) получают так называемую первую теплоту растворения (∆Н0p).
Допуская, что процесс растворения соли слагается из разрушения ее кристаллической решетки и образования сольватов (в случае воды – гидратов), согласно закону Гесса имеем:
ΔНр= ΔНф+ ΔНс
где ΔНф и ΔНс - энтальпии превращения кристаллической решетки в ионный газ (фазовый переход) и сольватации ионов (в случае воды -гидратации).
Интегральную теплоту растворения определяют калориметрически. Значение интегральных теплот растворения некоторых солей и оснований в наиболее известных растворителях приведены в справочниках.
11.6. Как и любой химический процесс, реакция нейтрализации сопровождается тепловым эффектом, зависящим от многих факторов: природы растворителя и взаимодействия кислоты и основания, их концентрации, температуры системы и т.п. Принято считать тепловой эффект, сопровождающий нейтрализацию 1 моль эквивалента кислоты (основания) соответствующим количеством основания (кислоты), теплотой нейтрализации (или это тепловой эффект реакции образования 1 моль жидкой воды из ионов Н+ и ОН-).
Опыт показывает, что при нейтрализации достаточно разбавленных водных растворов сильных кислот (оснований) сильными основаниями (кислотами), независимо от их природы наблюдается один и тот же тепловой эффект, зависящий только от температуры.
ΔНН = - 56312,36 + (Т - 298) 209,34 Дж/моль
Это объясняется тем, что нейтрализация сильных кислот (оснований) сильными основаниями (кислотами) в водных растворах сводится к реакции
Н+ + ОН- —> Н2О(ж)
В разбавленных растворах, а также в растворах слабых электролитов одновременно с указанной основной реакцией при нейтрализации протекает диссоциация электролита
НА —> Н+ + А- МеОН —> Ме+ + ОН- ΔНдис
Поэтому теплота нейтрализации зависит от природы и концентрации взаимодействующих кислот и оснований.
Согласно закону Гесса фактическая теплота нейтрализации
ΔНф=ΔНн+ΔНдис
Так тепловой эффект взаимодействия HClразб и КОНразб. при 20°С равен - 57359,16 Дж/моль, что соответствует ΔНн.
При тех же условиях взаимодействие растворов аммиака и соляной кислоты сопровождается тепловым эффектом, равным ΔНф = - 51916,32 Дж/моль (Δ Ндис. = 5442,84 Дж/моль), а растворов уксусной кислоты и гидроксида калия - ΔНф = - 55265,76 Дж/моль (ΔНдис. = 2083,4 Дж/моль).
11.7. Закон Гесса имеет множество различных формулировок, названных следствиями из закона. Они широко применяются в термохимических расчетах.
I следствие: тепловой эффект разложения какого-либо химического соединения равен по абсолютной величине и противоположен по знаку тепловому эффекту образования этого соединения.
II следствие: если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое.
III следствие: если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного конечного состояния в другое.
Используя значения теплот (энтальпий) образования веществ, участвующих в реакции, можно рассчитать тепловой эффект этой реакции. Это легко сделать, используя
IV следствие; тепловой эффект реакции при стандартных условиях равен разности между суммой теплот (энтальпий) образования продуктов реакции и суммой теплот (энтальпий) образования исходных веществ, умноженных на соответствующие стехиометрические коэффициенты.
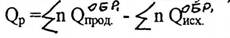 или
или
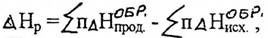
где ∆Н - изменение энтальпии соответствующей реакции;
n - число моль веществ, равное стехиометрическому коэффициенту. Это следствие широко применяют в теплотехнических расчётах химико-технологических процессов любого профиля;
для исследования органических реакций используют в основном
V следствие: тепловой эффект реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты.
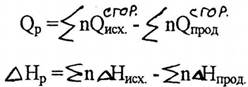
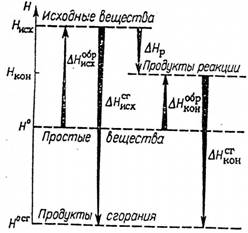 Рис. 2.7. К пояснению закона Гесса и его следствий:
Рис. 2.7. К пояснению закона Гесса и его следствий:
Н° и Н° сг - это энергетические уровни простых веществ и продуктов полного сгорания; Нисх. и Нкон. - энергетические уровни системы в исходном состоянии (энергия исходных веществ) и в конце процесса (энергия продуктов реакции); ∆Нисхобр и ∆Нконобр – изменения энтальпии при образовании исходных веществ и продуктов реакции из простых веществ; ∆Нисхсг и ∆Нконсг – изменения энтальпии при полном сгорании исходных веществ и продуктов реакции; ∆Нр- изменение энтальпии в результате протекания реакции.
На рис.2.7 дано графическое пояснение к закону Гесса и его следствиям. Направления стрелок указывают на направления рассматриваемых процессов, а их длина соответствует величине изменения энтальпии системы в ходе соответствующего процесса.
Из рис.2.7 следует, что
- ∆Нисхсг = - ∆Нр - ∆Нконсг; ∆Нисхобр = -∆Нр +∆Нконобр
Направления стрелок, совпадающие с направлением оси Н, принято за положительное (∆Н>0), а противоположное - за отрицательное (∆Н<0). Решая полученные равенства относительно теплового эффекта рассматриваемой реакции, получаем
∆Нр=∆Нисхсг -∆Нконсг; ∆Нр = ∆Нконобр - ∆Нисхобр
что подтверждает справедливость двух последних следствий закона Гесса.
11.8. Тепловой эффект реакции - это результат изменения химической энергии, происходящего при химических превращениях. Но химические превращения влекут за собой и изменения физических свойств: объема, плотности, теплоемкости, теплопроводности и т.п., что сказывается и на тепловом эффекте реакции.
Особо важное значение для теплового эффекта реакции имеет изменение теплоемкости системы. Дело в том, что часть внутренней энергии представляющая собой энергию теплового движения молекул системы (тепловая составляющая внутренней энергии), зависит от ее температуры и теплоемкости, т.е. от ее физических свойств. Это значит, что тепловая составляющая внутренней энергии различных веществ, взятых в одинаковых количествах и при одинаковых температурах, различна: большая - для веществ с большей теплоемкостью, и меньшая - для веществ с меньшей теплоемкостью.
Таким образом, в результате изменения химической природы системы, приводящего к изменению ее теплоемкости, возможно освобождение или связывание некоторого количества энергии за счет изменения тепловой составляющей внутренней энергии системы. При различных температурах величина этого изменения различна. Следовательно, тепловой эффект реакции зависит от температуры реагирующей системы (температура реакции). Для выявления этой зависимости обратимся к следующим рассуждениям.
Допустим, что тепловой эффект реакции
aA+bB→cC+dD
при Т1 равен Qp/=H2-H1 а при Т2 равен Qp//=H/2-H/1
Тогда изменение теплового эффекта при изменении температуры реакции на 1 градус равно:
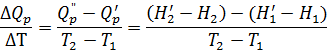
Преобразуя это выражение, получаем:
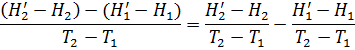
Но Н/1 – H1 и Н/2 – H2 – это изменения энтальпий исходных веществ и продуктов реакций при изобарическом изменении их температуры на ΔТ=Т2-Т1. Откуда, согласно (2.24а и 2.9) имеем:
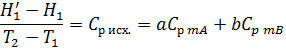
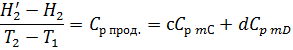
Учитывая последнее, окончательно получаем:
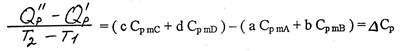
А решив это уравнение относительно Q//P, получим выражение, удобное для практических целей
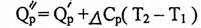 (2.29)
(2.29)
Или в общем виде
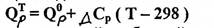 (2.30)
(2.30)
где QPO – стандартный изобарный тепловой эффект реакции;
QPT – изобарный тепловой эффект при температуре Т.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3268; Нарушение авторских прав?; Мы поможем в написании вашей работы!