
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика процессов плазмохимического травления
|
|
|
|
 В неизотермической низкотемпературной газоразрядной плазме концентрация ХАЧ (атомов, радикалов) определяется не термодинамическим равновесием, а стационарным состоянием плазмы, возникающим в результате генерации и рекомбинации частиц. Для вывода уравнения, описывающего изменения концентрации ХАЧ в элементе объема плазмы трубчатого реактора, можно воспользоваться закономерностями, приведенными для потоков ранее.
В неизотермической низкотемпературной газоразрядной плазме концентрация ХАЧ (атомов, радикалов) определяется не термодинамическим равновесием, а стационарным состоянием плазмы, возникающим в результате генерации и рекомбинации частиц. Для вывода уравнения, описывающего изменения концентрации ХАЧ в элементе объема плазмы трубчатого реактора, можно воспользоваться закономерностями, приведенными для потоков ранее.
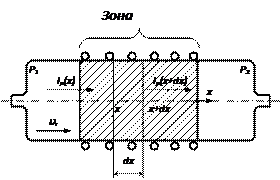
Будем считать, что в зоне плазмы (рис. 11.11) существуют положительный градиент ХАЧ dn ХАЧ/ dx >0 и газовый поток, вызванный перепадом давлений p 1> p 2 на входе и выходе реактора, перемещающийся со скоростью uг. В соответствии с рис. 11.11 изменение числа ХАЧ в слое dx завремя dt составит
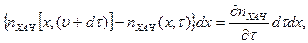
(495 11.43)
где n ХАЧ(x,t), n ХАЧ[ x,(t+dt)] —концентрация ХАЧ в слое в моменты времени t и t+dt.
Изменение числа ХАЧ в слое вызывается происходящими в нем процессами генерации и рекомбинации, диффузии (из-за градиента концентрации) и течения газа (из-за градиента давления).
Примем скорость генерации ХАЧ в единице объема плазменной зоны равной uген, а скорость их рекомбинации—uр. Тогда за время dt в слое объем dx создается uген dtdх, а убывает uр dtdx ХАЧ. Наличие градиента концентрации и газового потока, перемещающегося со скоростью ur, приводит к тому, что поток ХАЧ J ХАЧ (х), входящий в слой dx, не равен потоку ХАЧ J ХАЧ (x+dx), выходящему из слоя. Изменение числа ХАЧ в слое за время dt, вызванное этим различием, составляет
[ J ХАЧ (x) - J ХАЧ (x+dx) ] dt = -(¶ J ХАЧ / ¶ x) dxdt. (496 11.44)
Полное изменение числа ХАЧ в слое dx за время dt
(¶ п ХАЧ / ¶ t) dtdx =[(-¶ J ХАЧ / ¶ x)+ uген+uр] dtdx. (497 11.45)
Сократив правую и левую части выражения (497 11.45) на dtdx, получим уравнение непрерывности для ХАЧ в плазме:
|
|
|
¶ п ХАЧ / ¶ t =-¶ J ХАЧ / ¶ x + uген+uр. (498 11.46)
Преобразуем выражение (498). Поток J ХАЧ удобно выразить в виде двух составляющих потоков: газового J г=uг n ХАЧ и диффузионного J д=- D ХАЧ dn ХАЧ/ dx (D ХАЧ – коэффициент диффузии ХАЧ). Тогда полный поток ХАЧ
J д=- D ХАЧ (dn ХАЧ/ dx) + uг n ХАЧ. (499 11.47)
Подставив выражение (499 11.47) в (498 11.46), найдем
¶ п ХАЧ / ¶ t = D ХАЧ (¶ 2n ХАЧ/¶ x2) - uг(¶ n ХАЧ/¶ x) + uген+ uр (500 11.48)
Если ¶ п ХАЧ / ¶ t =0, то уравнение непрерывности (500) примет вид
D ХАЧ (¶ 2n ХАЧ/¶ x2) - uг(¶ n ХАЧ/¶ x) + uген+ uр = 0. (501 11.49)
Для трехмерного случая и случая, когда газовый поток является функцией координат, соотношение (500) можно записать так:
¶ п ХАЧ / ¶ t= D ХАЧ D п ХАЧ – grad(п ХАЧ uг) + uген+ uр, (502 11.50)
где D=¶2/¶ x 2 + ¶2/¶ y 2 + ¶2/¶ z 2- оператор Лапласа; grad= ¶/¶ x i + ¶/¶ y j + ¶/¶ z k (i, j, k – единичные векторы вдоль осей координат).
Отметим, что в уравнениях (500)—(502) под скоростью uр подразумевается суммарная скорость рекомбинации ХАЧ в единице объема плазменной зоны реактора вследствие гомогенной и гетерогенной (на стенках и электродах реактора) рекомбинаций и реакции травления рабочего материала, т. е.
uр= uр.гом + uр.гет + uтр, (503 11.51)
где uр.гом, uр.гет, uтр— скорости рекомбинации ХАЧ в единице объема плазменной зоны реактора за счет гомогенной и гетерогенной рекомбинаций, а также травления рабочего материала.
Решение уравнения непрерывности с учетом значений этих скоростей позволяет определить стационарную, концентрацию ХАЧ в элементе объема реактора.
Процессы ПХТ материалов являются гетерогенными и многостадийными. В их механизме можно выделить те же стадии, что и в любом физико-химическом процессе: миграция молекул рабочего газа в зону плазмы газового разряда; превращение их в плазме в энергетические и химически активные частицы; движение энергетических и химически активных частиц к поверхности обрабатываемого материала; взаимодействие их с обрабатываемой поверхностью; отвод продуктов взаимодействия от поверхности.
|
|
|
Скорость гетерогенных многостадийных процессов зависит от скорости лимитирующей (наиболее медленной) стадии. Следовательно, для нахождения закономерностей ПХТ материалов нужно выявить лимитирующую стадию и определить, какие параметры влияют на ее скорость. Поэтому необходимо проанализировать каждую из перечисленных стадий.
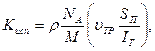 Движение молекул рабочего газа в зону плазмы характеризуется скоростью потока, (расхода газа) и зависит от конструкции реактора, обеспечивающей максимальную эффективность использования газа. Для оценки влияния потока рабочего газа на скорость травления удобно ввести коэффициент использования рабочего газа К исп, равный отношению скорости удаления атомов материала с поверхности к скорости потока молекул рабочего газа на эту поверхность:
Движение молекул рабочего газа в зону плазмы характеризуется скоростью потока, (расхода газа) и зависит от конструкции реактора, обеспечивающей максимальную эффективность использования газа. Для оценки влияния потока рабочего газа на скорость травления удобно ввести коэффициент использования рабочего газа К исп, равный отношению скорости удаления атомов материала с поверхности к скорости потока молекул рабочего газа на эту поверхность:
(504 11.52)
где r—плотность травящегося материала; N A — число Авогадро; М— относительная молярная (атомная) масса материала.
Обычно J г= 1—100 см3/мин в зависимости от вида разряда и конструкции реактора.
Если поток травящегося вещества с поверхности равен 1 см3/мин (что эквивалентно 2,69*1019 мол/мин), то для кремния

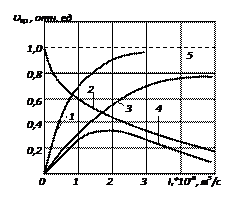 K исп=1,11*10-2uтр S п/ J г, (505 11.53)
K исп=1,11*10-2uтр S п/ J г, (505 11.53)
а для диоксида кремния
K исп=5,93*10-3uтр S п/ J г. (506 11.54)
На рис. 11.12 приведены зависимости скорости травления материалов от расхода рабочего газа. При травлении материалов с использованием ХАЧ следует выбирать оптимальное значение расхода рабочего газа, чтобы, с одной стороны, не ограничивать скорость травления материалов недостатком ХАЧ, а с другой — не откачивать непрореагировавшие ХАЧ. Рекомендуется такой расход газа, при котором K исп>20%. При I r=const и K исп>60% в реакторе из-за диссоциации молекул рабочего газа и образования летучих продуктов реакции травления может увеличиваться давление и изменяться состав рабочего газа. Это приводит к снижению скорости и селективности травления материала.
Скорость химической реакции ХАЧ на поверхности зависит от концентрации ХАЧ. Для реакций первого порядка
u = Kn пХАЧ (507 11.55)
где К— константа скорости химической реакции; n пХАЧ — концентрация ХАЧ на поверхности травления.
В стационарном состоянии скорость реакции ХАЧ на поверхности обрабатываемого материала должна быть равна числу ХАЧ, доставляемых к поверхности в единицу времени в результате молекулярной или конвективной диффузии. Диффузионный поток ХАЧ к поверхности
|
|
|
J д=(D ХАЧ/dп.с)(n ХАЧ - n пХАЧ), (508 11.56)
где dп.с — толщина пограничного слоя, в котором происходит резкое изменение концентрации ХАЧ.
Приравняв (507) и (508), с учетом (D ХАЧ/dп.с)=b (b—коэффициент массоотдачи) найдем
b(n ХАЧ - n пХАЧ)= K n пХАЧ. (509 11.57)
Вычислив из выражения (509 11.57) концентрацию n пХАЧ и подставляя ее в (507 11.55), получим
u= n пХАЧ K b/(K +b). (510 11.58)
В этом случае скорость реакции описывается уравнением реакции первого порядка по концентрации ХАЧ:
u = K¢n ХАЧ, (511 11.59)
где
К'= (K b)/(K +b) (512 11.60)
—приведенная константа скорости химической реакции.
Формула (512 11.60) примет наглядный вид, если вместо константы скорости реакции и коэффициента массоотдачи рассматривать их обратные величины:
1/ K'= 1/ K+ 1/b
Обратные величины константы скорости реакции и коэффициента массоотдачи называются кинетическим и диффузионным сопротивлениями.
Заметим, что при K >>b (диффузионное сопротивление больше кинетического) из выражения (512 11.60) следует, что K'= b, а из соотношения (509 11.57), что n пХАЧ<< n ХАЧ. В этом случае скорость суммарного процесса определяется скоростью диффузии ХАЧ к поверхности обрабатываемого материала (диффузионная область). Очевидно, что в диффузионной области наблюдаемая кинетика реакции отличается от истинной кинетики реакции на поверхности. Реакции, протекающие в этой области, имеют первый порядок по концентрации ХАЧ при постоянном давлении:
u= b n ХАЧ= n ХАЧ D ХАЧ/dп.с = n ХАЧ D ХАЧ Num/ l p, (513 11.62)
где Nu—критерий Нуссельта; m— эмпирический коэффициент, l p—характерный размер реактора.
Скорость реакции в диффузионной области так же, как коэффициент диффузии, зависит от температуры и так же, как критерий Нуссельта,— от скорости газового потока (т. е. пропорциональна скорости газового потока в степени 0,4—0,5) и не зависит от особенностей механизма реакции. Скорости самых различных реакций в диффузионной области различаются только коэффициентами диффузии ХАЧ. Диффузионная область реализуется при высоких температурах и давлениях и малых скоростях газового потока.
|
|
|
При травлении материалов ХАЧ уменьшение скорости травления материала с увеличением обрабатываемой площади (числа образцов) указывает на то, что процесс протекает в диффузионной области (загрузочный эффект или эффект истока).
Если K >>b, скорость реакции совпадает со скоростью реакции на поверхности, а концентрация ХАЧ у поверхности—с концентрацией ХАЧ в объеме (n пХАЧ= n ХАЧ). Скорость реакции (11.55) зависит от температуры (по закону Аррениуса) и почти не зависит от скорости газового потока. Она пропорциональна площади обрабатываемой поверхности. Область, в которой реализуется истинная кинетика реакции, называется кинетической.
Следует отметить, что в диффузионной области скорость и равномерность травления материалов определяются концентрацией ХАЧ и ее распределением у поверхности обрабатываемого материала. Они мало зависят от уровня и распределения температуры и концентрации активных центров на поверхности материала. В кинетической же области скорость и равномерность травления в основном характеризуются уровнем и распределением температуры и концентрации активных центров на поверхности материала.
Между диффузионной и кинетической областями находится переходная область, в которой скорость реакции первого порядка определяется выражением (11.58).
Формулы (11.55), (11.58) и (11.62) имеют простое молекулярно-кинетическое объяснение. Если концентрация ХАЧ у поверхности обрабатываемого материала n пХАЧ, то
поток ХАЧ на поверхность




 I пХАЧ=1/4 n пХАЧ u, (11.63)
I пХАЧ=1/4 n пХАЧ u, (11.63)
где u=[8kTХАЧ /(pmХАЧ)] —средняя скорость тепловбго движения ХАЧ.
Если вероятность взаимодействия ХАЧ с поверхностью материала Р, то скорость химической реакции
u =1/4 Pn пХАЧ u, (11.64)
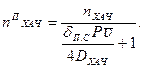 В результате реакции ХАЧ с поверхностью пластин концентрация ХАЧ в поверхностном слое толщиной dп.с уменьшаетсяот n ХАЧ в объеме до n пХАЧ у поверхности, т. е. создается диффузионный поток ХАЧ из объема к поверхности в соответствии с (11.56). Приравняв выражения (11.64) и (11.56), найдем
В результате реакции ХАЧ с поверхностью пластин концентрация ХАЧ в поверхностном слое толщиной dп.с уменьшаетсяот n ХАЧ в объеме до n пХАЧ у поверхности, т. е. создается диффузионный поток ХАЧ из объема к поверхности в соответствии с (11.56). Приравняв выражения (11.64) и (11.56), найдем
(11.65)
Подставив (11.65) в (11.64) при D ХАЧ =1/3 lХАЧ u (lХАЧ - длина свободного пробега частиц в реакторе), после несложных преобразований получим

(11.66)
т. е. скорость химической реакции ХАЧ с поверхностью пластин равна свободному потоку ХАЧ (1/4 u n ХАЧ), деленному на сумму диффузионного (3dп.c/4lХАЧ) и кинетического ( 1/ Р) сопротивлений. Формула (11.66) является молекулярно-кинетическим аналогом
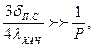
формулы (11.58). В диффузионной области, когда
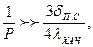 |
Выражение (11.66) совпадает с выражением (11.62), а в кинетической области, когда
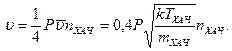
Подчеркнем, что химическая стадия взаимодействия ХАЧ с активными центрами пластины (материала) состоит из трех подстадий: хемосорбции ХАЧ на активных центрах, химической реакции и десорбции образующихся продуктов реакции. Поэтому любая из этих подстадий может быть лимитирующей для травления, протекающего в кинетической области.
Ускорение процессов десорбции, например, электронным или ионным облучением повышает скорость травления материала. Для десорбции продуктов реакции при условии, что с продуктом реакции удаляется один атом травящего материала, скорость травления
uтр=(uдес M)/(r N A), (11.68)
где uдес — скорость десорбции продуктов реакции с единицы поверхности.
Адсорбция ХАЧ и десорбция продуктов реакции влияют на энергию активации химической реакции на поверхности. Поэтому энергия активации химической реакции, определяемая по зависимости скорости травления от температуры, является не истинной, а кажущейся. Если материал пластины травится ХАЧ одного вида, слабо адсорбирующимися на его поверхности, и продукты травления не тормозят процесс травления, то связь между истинной Еа и кажущейся Еа.к энергиями активации определяется соотношением
Еа.к=Еа - D Н адс , (11.69)
где D Н адс — теплота адсорбции ХАЧ.
Когда адсорбция ХАЧ слабая, а продукта реакции — сильная, то
Еа.к=Еа - D Н адс + D Н п.радс, (11.69)
где D Н п.радс —теплота адсорбции продукта реакции.
Таким образом, для расчета истинной энергии активации химической реакции травления необходимо знать теплоту адсорбции ХАЧ и образующихся продуктов реакции. Экспериментальные значения энергий активации реального ПХТ кремния, диоксида кремния и нитрида кремния в парах фреона (CF4) составляют 13 кДж/моль, 17,7 кДж/моль, 16,7 кДж/моль соответственно. Для сравнения отметим, что энергия активации травления кремния молекулярным фтором составляет 33,1 кДж/моль.
При ПХТ поверхность материала подвергается электронной и ионной бомбардировке. В результате увеличивается скорость десорбции молекул продуктов реакции, образуются новые активные центры на поверхности материала, что увеличивает скорость травления материалов.
Таким образом, термодинамический и кинетический анализ процессов, протекающих при ПХТ, показывает, что они могут рассматриваться с тех же позиций, что и химические процессы. Однако они более сложны, чем чисто химические, и имеют большее число влияющих факторов. Поэтому и способы их контроля и регулирования с целью создания оптимальных технологий также являются более сложными. При этом возможности варьирования технологическими факторами более широкие.
В качестве примера приведем расчет скорости травления для кремниевых пластин.
Расчет скорости травления uтр материала можно провести, считая
uтр=uK тр M /(r N A). (11.71)
Подставив в выражение (11.71) значение скорости реакции в диффузионной области из (11.62), получим
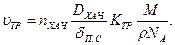 (11.72)
(11.72)
Согласно (11.67) и (11.71) для кинетической области.
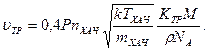 (11.73)
(11.73)
Для переходной области с учетом (11.66) и (11.71)
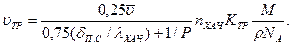 (11.74)
(11.74)

 Считая D хач =0,33lХАЧu; u=[ kT ХАЧ/(8p m ХАЧ)]1/2, уравнение (11.72) можно записать в виде
Считая D хач =0,33lХАЧu; u=[ kT ХАЧ/(8p m ХАЧ)]1/2, уравнение (11.72) можно записать в виде
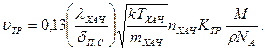 (11.75)
(11.75)
При расчете скорости травления для диффузионной области при условии, что распределение по скоростям ХАЧ является максвелловским, lХАЧ/dп.с=1,7.
При травлении Si атомами F согласно (11.13) подставим в (11.75) lХАЧ/dп.с=1,7;
K тр=0,25 ат/ХАЧ; М= 28 г/моль; r =2,42*103 кг/м3; mхач =31,6*10-27 кг; Nа =6,023*1023 ат/моль. Тогда
uтр =4,67*10-28 n ХАЧ(T ХАЧ)1/2. (11.76)
Сравнение экспериментальных данных при травлении Si в ВЧ плазме, содержащей CF4, для р =20—100 Па с расчетными по формуле (11.76.) показало их хорошее соответствие.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 773; Нарушение авторских прав?; Мы поможем в написании вашей работы!