
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы химических реакций
|
|
|
|
Все многообразие неорганических веществ возникает в результате протекания химических реакций.
В неорганическом синтезе используются практически все типы химических реакций, протекающие без изменения и с изменением степени окисления реагирующих веществ.
Вспомним основные типы реакций.
Ø Реакция соединения А + В + С = Д
СаО + WO3 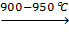 CaWO4
CaWO4
Особое значение для синтеза имеют так называемые реакции образования:
2Al + 3S = Al2S3
2Ti + N2 = 2TiN
Термодинамические характеристики реакций образования табулированы - значения DG, DH, DS приводятся во многих справочниках.
Ø Реакция разложения А = В + С + Д
2Cu(NO3)2 = 2CuO + 4NO2 + O2
К этому типу относятся все реакции термической диссоциации, по которым можно получать соединения низших валентностей.
Например, исходя из полиселенидов церия Ce, прозеодима Pr, неодима Nd и самария Sm можно получить сесквиселениды (полуторные) редкоземельных элементов по реакциям в общем виде:
2M2Se4 ® 2M2Se3 + Se2
или
M2Se4  M2Se3
M2Se3 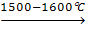 M3Se4
M3Se4
Аналогично, можно синтезировать некоторые селениды переходных металлов исходя из диселенидов:
2MSe2 ® M2Se3 + Se
Иногда эту реакцию объединяют с реакцией соединения. Например, при получении Mo3Se4:
6MoSe2 + 3Mo ® 3Mo3Se4
Особый случай - реакции диспропорционирования или дисмутации. Они сопровождаются одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента:
Cl2 + H2O = HClO + HCl
4KClO3 = 3KClO4 + KCl
3Al2S(г) (субсульфид) = Al2S3 + 4Al
Ø Реакция замещения А + ВС = АВ + С
Простое вещество реагирует со сложным, образуя новые простое и сложное вещества.
Zn + 2HCl = ZnCl2 + H2
Многочисленные восстановительные процессы, например алюмотермия, карботермия относятся к этому типу
Fe2O3 + 2Al = 2Fe + Al2O3
|
|
|
Эти реакции в сочетании с реакциями разложения используются для синтеза простых и сложных веществ d- элементов:
CuSeO4 + 4H2 = CuSe + 4H2O
Ø Реакции обмена АВ + СД = АС + ВД
CuSO4 + H2S = CuS + H2SO4
Помимо классификации реакций по числу частиц и характеру их взаимодействия, химические процессы можно классифицировать по другим признакам:
· по механизму (ионные, радикальные, цепные и т.п.)
· по агрегатному состоянию (гомогенные, гетерогенные)
· по кинетическим характеристикам:
- по молекулярности (моно-, би- и тримолекулярные)
- по порядку реакции (первый, второй, третий, дробный)
· по тепловому эффекту (экзо- и эндотермические)
Для нас особый интерес представляют гомогенные реакции, протекающие в газовой фазе. К ним относятся так называемые транспортные реакции, по которым получают монокристаллы и особо чистые вещества.
Большинство тугоплавких неорганических веществ получают по гетерогенным твердофазным реакциям при высоких температурах. Преимущества высокотемпературного синтеза в случае твердофазных реакций:
1. скорость реакции возрастает экспоненциально с ростом температуры;
2. диффузия атомов в кристаллической решетке также растет экспоненциально с ростом температуры;
3. при взаимодействии металлов с неметаллами выделяется тепло, которое можно использовать для поддержания реакции;
4. образующаяся пленка продукта меньше тормозит реакцию при высоких температурах.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 576; Нарушение авторских прав?; Мы поможем в написании вашей работы!