
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
I. Циклизации
|
|
|
|
Сохранение орбитальной симметрии
Лекция 24
(правила Вудворда-Хоффмана)
[Излагается по книге «Введение в фотохимию органических соединений», под ред. А.В. Ельцова, Л.: «Химия», 1976.–384 с. С. 258 и далее].
Позволяют объяснить и предвидеть основные черты структурного и стереохимического хода синхронных фотохимических и термических реакций на основе симметрии волновых функций (орбиталей).
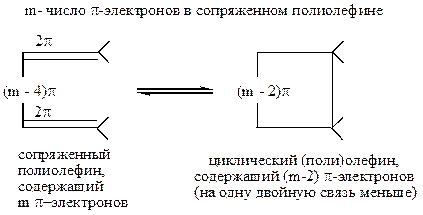
Например:
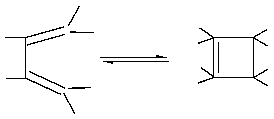
Наибольшие изменения при циклизации происходят у концевых атомов полиеновой системы, которые связываются при замыкании цикла σ-связью, т. е. переходят из sp2- в sp3-состояние. Такая σ-связь, в соответствии с квантово-механическими представлениями о химической связи и молекулярных орбиталях, может возникнуть только тогда, когда между π-орбиталями в процессе перегибридизации до σ-орбиталей (т. е. sp2 → sp3) происходит связывающее перекрывание. Это возможно только в случае, если волновые функции перекрываются в области одинаковых знаков с образованием симметричной молекулярной орбитали (так называемые «электроциклические реакции»):
а) дисротаторный процесс (орбитали концевых атомов поворачиваются в противоположных направлениях):
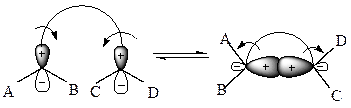
| Конротаторная реакция строго запрещена. |
б ) конротаторный процесс (орбитали концевых атомов поворачиваются в одинаковых направлениях):
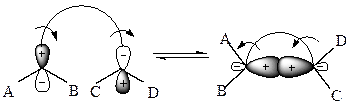
| Дисротаторная реакция строго запрещена. |
Реакции этого типа обратимы, так что для раскрытия кольца справедливы те же самые соображения.
1. Рассмотрение симметрии ВЗМО
В дальнейшем рассмотрении исходят из того, что в реакции участвует в принципе лишь одна занятая орбиталь с максимальной энергией (ВЗМО). Далее нужно установить тип симметрии ВЗМО (например с помощью модели потенциального ящика).
|
|
|
Рассмотрим это в упрощенном варианте на примере циклизации производных бутадиена.
В основном состоянии ВЗМО бутадиена является орбиталь ψ2, следовательно, циклизация в основном состоянии (термическая циклизация) происходит путем конротаторного замыкания кольца:
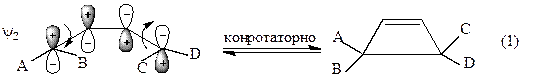
Разрешена термическая реакция.
В фотовозбужденном состоянии ВЗМО бутадиена является орбиталь ψ3*, и циклизация в возбужденном состоянии (фотохимическая циклизация) возможна только путем дисротаторного замыкания цикла:
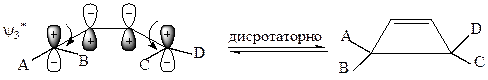
Разрешена фотохимическая реакция.
В соответствующих условиях сами кон- и дисротаторные реакции одинаково возможны, однако они ведут к различным стереохимическим результатам.
Иногда одно из двух направлений реакции исключено по другим причинам:
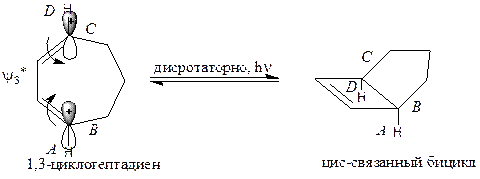
| Фотохимическая реакция возможна. |
Бицикл, образующийся из 1,3-циклогептадиена, из-за напряжения кольца способен существовать только при цис-связывании колец, которое возможно лишь при дисротаторном замыкании цикла.
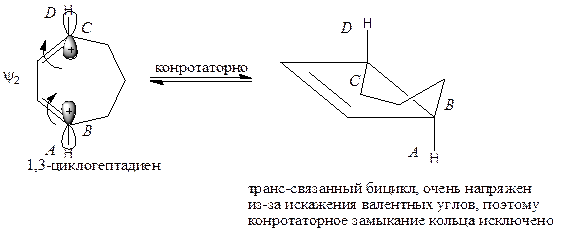
| Термическая реакция не идет. |
Рассматривая волновые функции ψ3 и ψ4* 1,3,5-гексатриена, можно легко убедиться, что циклизация до 1,3-циклогексадиена должна протекать дисротаторно при термическом процессе и конротаторно при фотохимическом:
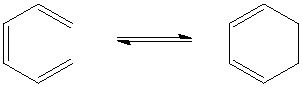
Следовательно, если рассматривают циклизацию триеновой системы 1,3,5-циклооктатриена, то здесь характер реакций меняется на противоположный по сравнению с диеновой системой 1,3-циклогептадиена:
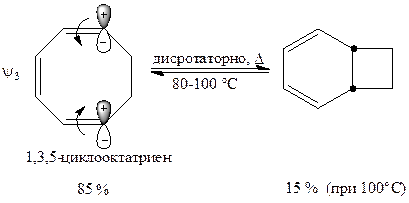
| Термическая реакция возможна, фотохимическая реакция не идет. |
Общие правила для определения характера электроциклических реакций в системе с κ π-электронами (правило Вудворда-Хоффмана для электроциклических реакций):
| Разрешенный процесс | κ | |
| 4q | 4q+2 | |
| термический | конротаторный | дисротаторный |
| фотохимический | дисротаторный | конротаторный |
|
|
|
где q – целое число, q=0, 1, 2…
В соответствии с этими правилами фотохимическое циклоприсоединение цис-стильбена дает транс-дигидрофенантрен:
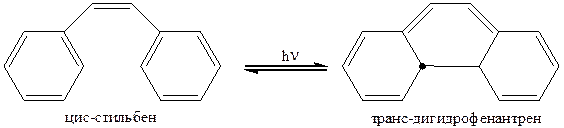
Используя поочередно термические и фотохимические реакции можно осуществить круговой процесс:
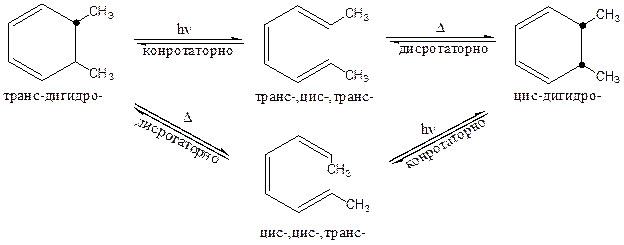
Вышеуказанные представления применимы также к олефиновым катионам, анионам и радикалам:

аллильный катион, по числу π-электронов соответствует этилену

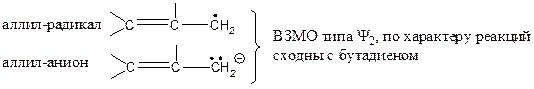
Изложенный выше подход является упрощенным, поскольку не учитывается симметрия орбиталей неконцевых атомов и молчаливо принимается образование новой связи С=С в конечном продукте (реакция 1), хотя обе атомные орбитали в исходном соединении разрыхляющие.
Этих недостатков лишен второй метод рассмотрения орбитальной симметрии и ее сохранения в ходе синхронных химических реакций, в том числе – электроциклических.
2. Корреляция всех участвующих в реакции орбиталей
Процесс рассматривается с точки зрения сохранения орбитальной симметрии всех участвующих в процессе молекулярных (в оригинале – атомных (с. 261)) орбиталей.
Исходят из того, что реакция может протекать конротаторно или дисротаторно, и на основе этого исследуют симметрию всех участвующих в реакции орбиталей. Для этого сначала устанавливают элемент симметрии, который сохраняется на всех стадиях реакции: исходные реагенты, переходные состояние, продукты реакции.
Для циклизации бутадиена этому условно соответствует вертикальная плоскость симметрии σv для дисротаторной реакции и ось вращения второго порядка С2 для конротаторной реакции:
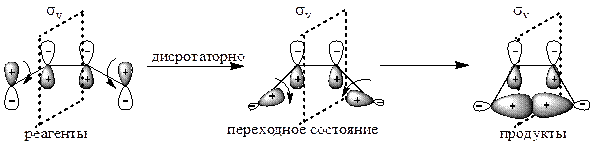
| Элемент симметрии – вертикальная плоскость симметрии σv (симметрия сохраняется при зеркальном отражении). |
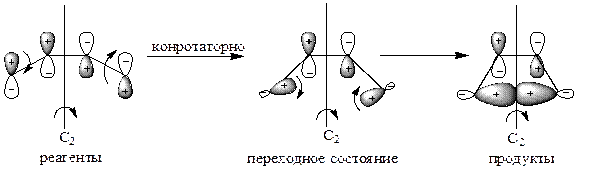
| Элемент симметрии – ось вращения второго порядка С2 (симметрия сохраняется при вращении на 180° вокруг оси С2). |
После установления элемента симметрии исследуют симметрию всех участвующих в процессе молекулярных орбиталей исходных реагентов и конечных продуктов и строят энергетическую диаграмму, располагая уровни молекулярных орбиталей в соответствии с их относительными энергиями, которые могут быть вычислены по методу МО. Затем соединяют попарно уровни одинаковой симметрии реагентов и продуктов (S реагента и S продукта, А реагента и А продукта), причем делают это отдельно для дисротаторного и отдельно для конротаторного процесса. Делают это так, чтобы не пересекались линии, соединяющие уровни одинаковой симметрии одного и того же вида, т. е. чтобы не пересекались линии S–S и S–S, А–А и А–А. Таким образом получают так называемую «корреляционную диаграмму»:
|
|
|
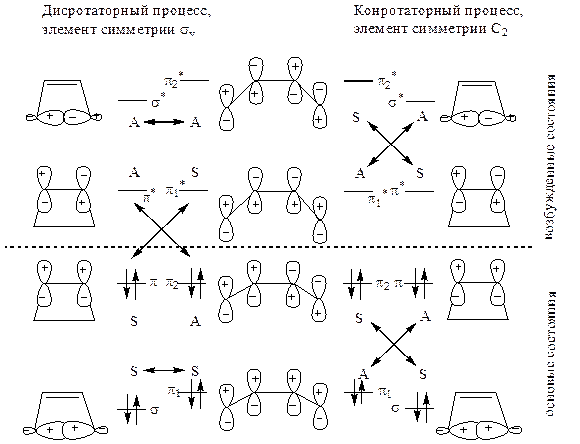
Корреляционная диаграмма системы цис-бутадиен – циклобутен.
A и S – симметричные и несимметричные орбитали, соответственно.
Из корреляционный диаграммы видно, что для конротаторной реакции, коррелируемый элементом симметрии С2, могут комбинироваться по симметрии друг с другом все участвующие в реакции орбитали обоих основных состояний – реагента и продукта, без участия возбужденных состояний, которые, в свою очередь, комбинируются между собой. Это означает, что для образования конечного продукта не нужно выходить из области основных состояний, которая находится ниже штриховой линии на рисунке. Другими словами, конротаторный процесс разрешен термически.
Таким образом, полный учет симметрии дает тот же результат, что и упрощенное рассмотрение по пункту 1, и найденное там условие осуществления термической реакции определяется требованиями сохранения орбитальной симметрии в ходе реакции.
С другой стороны, для дисротаторной реакции, коррелируемой элементом симметрии σv, симметрия орбиталей исходного реагента и конечного продукта (соединения с занятыми электронными уровнями) может комбинироваться лишь с привлечением волновых функций возбужденного состояния. Согласно этому необходимо, чтобы реакция проходила через возбужденное состояние, для чего требуется соответствующие условия. Это означает, что дисротаторный процесс разрешен только фотохимически и запрещен термически.
Вообще существуют три случая:
1) Симметрия исходных реагентов и конечных продуктов коррелируется без пересечения между основными и возбужденным состояниями. Разрешена термическая реакция и запрещена фотохимическая.
|
|
|
2) Симметрия реагентов и продуктов коррелируется с пересечением между основным и возбужденным состояниями. Разрешена фотохимическая реакция и запрещена термическая.
3) Имеется две или более корреляций орбиталей основного и возбужденного состояний. Запрещены как термическая, так и фотохимическая синхронные реакции.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1199; Нарушение авторских прав?; Мы поможем в написании вашей работы!