
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия как критерий направленности и равновесия процессов в изолированных системах
В отношении некоторых частных групп процессов и явлений опытным путём выявлен критерий, которым определяется возможность самопроизвольного процесса и возможный предел его протекания. Теплота может переходить самопроизвольно только от тела, обладающего более высокой температурой, к телу с более низкой температурой, причём температура первого из них будет при этом понижаться, а второго – повышаться. Известно также, что этот переход может происходить самопроизвольно лишь до такого состояния, когда температуры обоих тел станут равными.
Другой пример. Если соединить между собой два сосуда, содержащие какой-нибудь газ, то самопроизвольный переход газа из одного сосуда в другой возможен только в том случае, когда давление в этих сосудах неодинаково. Газ будет переходить из сосуда, в котором его давление больше, в сосуд с меньшим давлением. Переход газа может совершаться самопроизвольно только до того состояния, при котором давление в обоих сосудах станет одинаковым.
Следовательно, для каждого из таких процессов существует некоторый критерий, определяющий направление возможного самопроизвольного перехода и его предел (т.е. состояние равновесия). Для перехода теплоты таким критерием является температура, для перехода газа – давление.
Таким образом, указанный метод может быть выражен так: самопроизвольное протекание процесса взаимодействия между различными частями системы возможно только в направлении выравнивания фактора интенсивности (температуры, давления, электрического потенциала и др.) для всех частей системы; достижение одинакового значения этого фактора является пределом самопроизвольного течения процесса в данных условиях. Этот метод неприменим к однородным системам, он не применим в частности, к гомогенным химическим реакциям.
Второй метод является более общим, т.к. применим и к процессам, совершающимся в однородных системах. Он выражается следующим положением, вытекающим также из второго закона термодинамики: для любой термодинамической системы, при данных условиях её существования всегда имеется некоторый общий критерий, которым характеризуется возможность, направление и предел самопроизвольного протекания термодинамических процессов. Например, для изолированных систем таким критерием служит энтропия S.
Второй закон термодинамики устанавливает, что в изолированных системах самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает, и процесс может идти самопроизвольно только до такого состояния, при котором энтропия обладает максимальным для данных условий значением.
Это не означает, что осуществление процессов в обратном направлении невозможно, но такие (обратные) процессы не могут совершаться самопроизвольно и для их проведения требуется затрата работы извне. Мы можем переводить теплоту от одного тела к другому и в том случае, если эти тела обладают вначале одинаковой температурой. Взаимодействие водорода и кислорода с образованием воды вы может определённых условиях происходить самопроизвольно, и осуществление этой реакции даёт возможность получать соответствующее количество работы. Но, затрачивая работу, можно осуществить и обратную реакцию – разложение Н2О на Н2 и О2 − например, путём электролиза.
Второй закон термодинамики постулирует, что при самопроизвольном протекании процесса в изолированной системе её энтропия возрастает. В этом случае U и V сохраняются постоянными, нет теплообмена с окружающей средой (δQ=0). Тогда соотношение
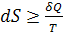 примет вид:
примет вид: 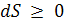 ;
;  (3.17)
(3.17)
- критерий самопроизвольности процессов в изолированных системах,
где знак = соответствует равновесному процессу, знак > – неравновесному процессу.
Самопроизвольный процесс протекает до тех пор, пока энтропия не достигнет максимально возможного значения при данных условиях, а система придет в равновесное состояние. При протекании равновесного процесса S изолированной системы – величина постоянная.
Необратимыми в термодинамическом смысле называются такие процессы, после протекания которых систему уже нельзя вернуть в начальное состояние без того, чтобы не осталось каких-нибудь изменений в ней самой или в окружающей среде.
В любых изолированных системах (в них могут совершаться только адиабатные процессы) S системы сохраняет постоянное значение (∆S=0), если в системе совершаются только обратимые процессы, и возрастает (∆S>0) при всяком необратимом процессе. Следовательно, в изолированных системах всякий самопроизвольно протекающий процесс сопровождается возрастанием энтропии.
|
|
Дата добавления: 2014-01-07; Просмотров: 6773; Нарушение авторских прав?; Мы поможем в написании вашей работы!