
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тепловая теорема Нернста. Постулат Планка. Абсолютное значение энтропии
|
|
|
|
В отличие от внутренней энергии 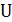 и энтальпии
и энтальпии 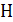 для энтропии можно определить абсолютные значения S. Эта возможность непосредственно не вытекает из второго закона термодинамики, а появляется лишь при использовании постулата Планка, называемого также третьим законом термодинамики.
для энтропии можно определить абсолютные значения S. Эта возможность непосредственно не вытекает из второго закона термодинамики, а появляется лишь при использовании постулата Планка, называемого также третьим законом термодинамики.
Опытные данные показывают, что теплоемкости Cp всех веществ при Т→0К резко падают до ничтожно малых величин (для кристаллов Cp уменьшается пропорционально Т3). Отношение 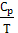 резко уменьшается, т.к. Cp уменьшается быстрее Т.
резко уменьшается, т.к. Cp уменьшается быстрее Т.
Результатом обобщения экспериментальных данных стала тепловая теорема Нернста (1906), которая гласит: вблизи 0 все процессы протекают без изменения энтропии (или с ничтожно малым изменением). Математическое выражение теоремы Нернста имеет следующий вид:
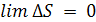 , (4.10)
, (4.10)
T → 0K.
Планк (1911) расширил тепловую теорему Нернста, считая, что при Т0= 0К, не только ∆S =0, но и S=0, тогда
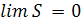 , (4.11)
, (4.11)
T → 0K.
Согласно постулату Планка – энтропия совершенного кристалла при ОК равна нулю.
Это положение не распространяется на дефектные кристаллы, стекла, твердые растворы и т.д. Для них энтропия при 0К ничтожно мала, но не равна 0 (S>0). В реальных кристаллах присутствуют ничтожные примеси, наблюдаются дефектные структуры, при этом энтропия мала, но S>0.
Таким образом, постулат Планка справедлив только для правильно образованных кристаллов. Следовательно, за начало отсчета можно принять S0=0. Постулат Планка оказался очень важным для химиков, т.к. появилось начальная точка отсчета (S0=0 при Т0=0) и можно вычислить абсолютное значение S при любой температуре. Обычно значение S рассчитывают для вещества в стандартном состоянии (р0=1атм, Т=298К), выражают в S°298 (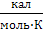 ) или (
) или (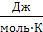 ) и табулируют.
) и табулируют.
|
|
|
Уравнение для вычисления абсолютного значения энтропии S имеет вид:
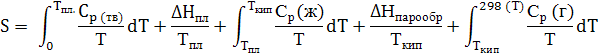
Для расчета энтропии необходимы данные по теплоемкости, определенные в интервале низких температур и теплоты фазовых переходов веществ. Если в твердом состоянии вещество имеет более одной модификации, надо добавить соответствующие слагаемые в правую часть уравнения.
Величина энтропии сложным образом отражает всю совокупность свойств соединения в данном агрегатном состоянии. Она зависит от молекулярной массы – для родственных веществ увеличивается с ее ростом; от агрегатного состояния – увеличивается при переходе от твердого тела→жидкости→газу; от кристаллического строения (например, графит, алмаз); от изотопного состава (H2 и D2, H2O и D2O), от строения молекул (н-бутан и изобутан).
Если нужны значения энтропии при других условиях (отличных от стандартных), проводится пересчет S по специальным уравнениям.
Изменение энтропии 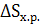 можно рассчитать, зная энтропии всех веществ участников реакции (с учетом стехиометрических коэффициентов):
можно рассчитать, зная энтропии всех веществ участников реакции (с учетом стехиометрических коэффициентов):
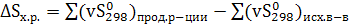 , (4.13)
, (4.13)
Величина изменения энтропии 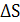 используется для выяснения возможности самопроизвольного протекания процесса (в изолированных системах), а также для расчета химических равновесий.
используется для выяснения возможности самопроизвольного протекания процесса (в изолированных системах), а также для расчета химических равновесий.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1844; Нарушение авторских прав?; Мы поможем в написании вашей работы!