
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмос и осмотическое давление
|
|
|
|
Пусть раствор и чистый растворитель разделены полупроницаемой мембраной. В системе идет процесс, который приводит к выравниванию химических потенциалов компонентов (раствора и растворителя). При этом молекулы растворителя будут самопроизвольно проходить через мембрану в раствор, что приведет к разбавлению раствора. Это явление впервые было открыто аббатом Нолле в 1748 г. и получило название осмоса.
Для изучения явления осмоса высокомолекулярных растворенных веществ используют естественные природные плёнки, полупроницаемые целлофановые пленки; для низкомолекулярных веществ – пленки ферроцианида меди Cu2[Fe(CN)6] и др.
Проникновение растворителя в раствор и его разбавление можно предотвратить, если к раствору приложить некоторое давление Р.
Давление, которое необходимо приложить к раствору для предотвращения явления осмоса (т.е. для приведения системы в состояние равновесия), называется осмотическим давлением (обозначается буквой π).

Рис. 8.2 Схема осмометра
Величина осмотического давления не зависит от природы мембраны, природы растворенного вещества и может быть измерено осмометром, (рис.8.2).
Если к раствору приложить более высокое давление (больше осмотического), химический потенциал растворителя в растворе станет больше, чем в чистом растворе и растворитель будет переходить из отдела ІІ (раствор) в отдел І (растворитель):
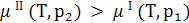 (8.11)
(8.11)
Это явление известно под названием обратный осмос (используется на практике для деминерализации воды).
Осмотическое давление раствора рассчитывается по формуле:
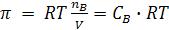 (8.12)
(8.12)
где СВ – молярность растворенного вещества,
π – осмотическое давление раствора.
|
|
|
Последнее уравнение применимо в области малых концентраций. Впервые его предложил Вант-Гофф в 1884 г. на основе анализа экспериментальных данных по осмотическому давлению растворов сахара.
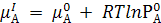 – уравнение химического потенциала
– уравнение химического потенциала
растворителя для прямого осмоса;
 – уравнение химического потенциала
– уравнение химического потенциала
для растворителя в растворе;
Следовательно,  (8.13)
(8.13)
Этим неравенством определяется направление переноса растворителя через мембрану из растворителя в раствор (прямой осмос).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 727; Нарушение авторских прав?; Мы поможем в написании вашей работы!