
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Нернста, применение
|
|
|
|
Международная конвенция (Стокгольм,1953) постановила, что при составлении схемы электрохимических цепей слева записывается отрицательный электрод (–) с меньшим значением электродного потенциала – анод; справа положительный электрод (+) с большим значением электродного потенциала – катод, например:
(–) Zn|ZnSO4||CuSO4|Cu (+)
Важнейшая количественная характеристика гальванического элемента – это электродвижущая сила Е.
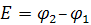 (12.9)
(12.9)
Если аПОИ 1моль, то Еº – стандартная ЭДС.
1моль, то Еº – стандартная ЭДС.
В случае элемента Якоби-Даниэля
 .
.
Согласно уравнению (12.7)
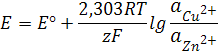
где Z1 = Z2=2,
F=96487≈96500к (число Фарадея),
T=298K.
 (12.10)
(12.10)
где  .
.
В общем случае для любой электрохимической цепи, когда Z1≠Z2 как отмечалось ранее

Для разбавленных растворов вместо активности можно использовать концентрации. Уравнение Нернста справедливо для гальванических элементов, составленных из двух металлических электродов.
Таким образом, уравнение Нернста может быть использовано для расчёта ЭДС гальванических элементов с учётом активности потенциалопределяющих ионов в цепи.
Если активность ионов металла в растворе не равна единице, то электродный потенциал металла не является стандартным. Зависимость электродного потенциала металла от активности потенциалопределяющих ионов в растворе дается уравнением электродного потенциала Нернста:
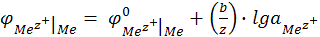 (12.11)
(12.11)
Вывод этой формулы может быть дан исходя из основного уравнения ЭДС гальванического элемента. Для определения электродного потенциала, как указано выше, составляют гальванический элемент, один из полуэлементов которого – стандартный водородный электрод, другой – исследуемый, например, медный.
|
|
|
(–) Pt, Н2 ( = 1) | Н + (
= 1) | Н + (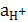 = 1) || Сu2++ (
= 1) || Сu2++ (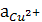 ) | Сu (+).
) | Сu (+).
ЭДС этого элемента, согласно уравнению Нернста
 (12.12)
(12.12)
так как Z1 =1, Z2= 2.
12.3 Классификация электродов в электрохимии: электроды первого рода, второго рода, газовые электроды, редокси-электроды
Электроды I рода это металлы или неметаллы, погруженные в растворы своих хорошо растворимых солей (обратимы по отношению к катиону или аниону)
Сu|CuSO4; Аg|AgNO3; S|Na2S; J2|KJ.
Для определения электродного потенциала составляют цепь:
(–) Pt, Н2 (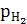 = 1) | Н + (
= 1) | Н + (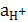 = 1) || Сu2++ (
= 1) || Сu2++ (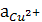 ) | Сu (+).
) | Сu (+).
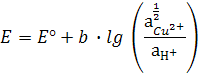
В электродах первого рода восстановленной формой является металл, а окисленной – ион металла.
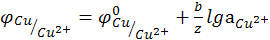 (12.13)
(12.13)
В общем случае
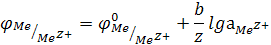
(для электродов, обратимых относительно катиона)

(для неметаллических электродов, обратимых относительно аниона)
К электродам первого рода также относятся амальгамные электроды, например, Hg,Cd|CdSO4 (используемые в элементе Вестона). Восстановленная форма амальгама – раствор металла в ртути, окисленная форма – Cd2+.
Электродная реакция
Cd2+ + 2 e ↔ Cd.
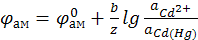 (12.14)
(12.14)
Электроды первого рода используют, как правило, в качестве индикаторных электродов. Индикаторные электроды позволяют определять активность ионов металлов путем измерения их потенциалов.
Электроды второго рода – металлы, покрытые слоем его трудно растворимой соли, погруженные в раствор хорошо растворимой соли с тем же анионом. Как правило, используются, как электроды сравнения. Примером электрода второго рода служит хлорсеребряный электрод.
Ag,AgCI|KCI; Ag,AgCI|CI–.
Электродная реакция:
AgCI(тв) + е ↔ Ag + CI–.
Скачок потенциала хлорсеребряного электрода:
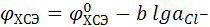 .
.
(обратим относительно аниона)
Другим наиболее часто используемым электродом второго рода является каломельный электрод, в котором паста из ртути и каломели Hg2CI2 помещена в раствор хлорида калия определенной концентрации:
|
|
|
Hg, Hg2CI2 | KCI.
Электродный процесс:
Hg2CI2(тв) + 2 е ↔ 2Hg (ж) +2CI–.
Электродный потенциал:
 (12.15)
(12.15)
Электродные потенциалы электродов второго рода относительно водородного электрода определены, легко воспроизводимы и устойчивы. Поэтому они применяются в качестве электродов сравнения, т.к. стандартный водородный электрод неудобен в применении.
Газовые электроды – водородный, кислородный. Металлом служит Pt, которая является адсорбентом газа и катализатором электродной реакции.
Электродные потенциалы газовых электродов зависят от активности потенциалопределяющих ионов в растворе и давления газа.
Pt,H2(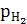 =1)|H2SO4(
=1)|H2SO4(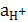 =1моль/л).
=1моль/л).
Если P≠1, 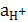 ≠1, водородный электрод не является стандартным, потенциал его не равен нулю и рассчитывается по формуле:
≠1, водородный электрод не является стандартным, потенциал его не равен нулю и рассчитывается по формуле:
 (12.16)
(12.16)
если 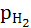 =1атм,
=1атм,
 (12.17)
(12.17)
Этот электрод состоит обычно из платинированной (платинированием называется покрытие поверхности слоем платиновой черни, т.е. слоем высокодисперсной платины) платиновой пластинки, опущенной в раствор, содержащий ионы водорода, и омываемой потоком газообразного водорода.
В водородном электроде протекает реакция
Н2 ↔ 2Н+ + 2 е.
Следовательно, электродный потенциал такого электрода зависит от концентрации ионов водорода в растворе, от давления водорода в газовой фазе и от температуры. При постоянном давлении 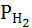 = 1 атм
= 1 атм

В качестве нормального (стандартного) водородного электрода (для которого электродный потенциал считается равным нулю) принимается водородный электрод, работающий при активности ионов водорода в растворе  = 1 моль/л и при давлении водорода в газовой фазе, равном 1 атм, причём водородный электрод и сочетаемый с ним другой электрод находятся при одинаковой температуре.
= 1 моль/л и при давлении водорода в газовой фазе, равном 1 атм, причём водородный электрод и сочетаемый с ним другой электрод находятся при одинаковой температуре.
Кислородный электрод Pt,O2 | OH–.
Электродная реакция:
O2 +2H2O+4 e ↔ 4OH–;
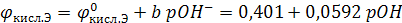
если 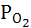 = 1атм и t = 25ºС
= 1атм и t = 25ºС
Окислительно-восстановительные, редокси-электроды.
Pt|Fe2+,Fe3+; Pt|Sn2+,Sn4+; Pt|H+,HAsO42- H3AsO3.
Это инертные электроды, помещенные в окислительно-восстановительную среду.
Материал электродов Pt, Au, Na – силикатные стекла с оксидами железа, графит. Электроды выполняют роль проводника электрического тока, окислительно-восстановительный процесс протекает в растворе.
|
|
|
Общий случай уравнения Нернста для расчёта электродных потенциалов:
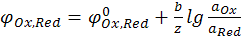 (12.18)
(12.18)
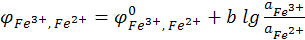 (12.19)
(12.19)
Электродный процесс:
Fe3+ + e ↔ Fe2+.
ПОИ (потенциалопределяющие ионы) – Fe3+ и Fe2+.
Кроме активностей окисленной и восстановленной форм соединений на величину Red-Ox потенциала систем, содержащих кислород влияет активность ионов Н+, так как восстановление таких систем идет с их участием.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4844; Нарушение авторских прав?; Мы поможем в написании вашей работы!