
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стеклянный электрод, электроды сравнения, электрометрическое измерении pH среды
|
|
|
|
Классификация и характеристика электрохимических цепей
Лекция 13. электрохимические цепи
Вопросы для самопроверки
1. Дайте определение понятия «стандартный электродный потенциал». Каким образом он определяется?
2. Что такое стандартный водородный электрод? Запишите и поясните его электрохимическую схему.
3. Сформулируйте правила записи электрохимических цепей.
4. Рассмотрите уравнение Нернста для расчёта ЭДС элемента Якоби-Даниэля.
5. Приведите вывод уравнения Нернста.
6. Что представляют собой электроды І и ІІ рода? Как рассчитываются электродные потенциалы указанных электродов?
7. Как влияет активность ионов и давление водорода в газовой фазе на электродный потенциал водородного электрода?
8. Что представляет собой редокси-электроды? Приведите примеры, напишите формулы для расчёта значения электродных потенциалов Red-Ox электродов.
13.1 Классификация и характеристика электрохимических цепей.
13.2Стеклянный электрод, электроды сравнения, электрометрическое измерение рН среды.
13.3 Ионометрия, ионоселективные электроды, применение.
Различают два основных типа электрохимических цепей:
ü химические (простые и сложные);
ü концентрационные.
Простые цепи. Нормальный элемент Вестона (стандартный эталон ЭДС). Нормальными называются такие гальванические элементы, которые могут служить эталоном для измерения электродвижущих сил. Эти элементы должны отвечать следующим основным требованиям: строгой воспроизводимости, минимальному температурному коэффициенту. Опыт показал, что элемент Вестона лучше, чем другие гальванические элементы отвечает этим условиям. В элементе Вестона электродами являются металлическая ртуть и амальгама кадмия, электролитом – раствор, насыщенный по отношению к сульфатам обоих металлов.
|
|
|
Электрохимическая схема элемента Вестона имеет следующий вид:
(–) Hg, Cd | CdSO4 | Hg2SO4, Hg (+).
Насыщенный раствор сульфата кадмия, находится в равновесии с кристаллогидратом CdSO4  H2O.
H2O.
Левый электрод – амальгамный электрод первого рода, правый – электрод второго рода.
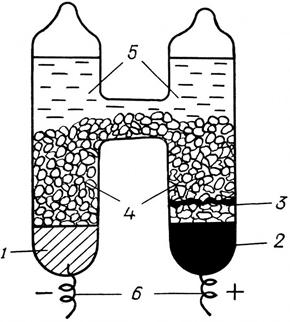
| Рис. 13.1 Стандартный (нормальный) элемент Вестона:
1 – амальгама кадмия;
2 – ртуть;
3 – паста из твёрдой соли сернокислой закиси ртути;
4 – кристаллы CdSO4  H2O;
5 – насыщенный раствор CdSO4;
6 – платиновые токоподводы. H2O;
5 – насыщенный раствор CdSO4;
6 – платиновые токоподводы.
|
Это пример электрохимической цепи без переноса, содержит один раствор электролита.
Процессы на электродах

ЭДС элемента точно измерена и при 20ºC равна 1,0183В.
Зависимость ЭДС от температуры выражается уравнением:
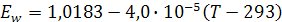 (13.1)
(13.1)
Элемент Вестона обладает ЭДС не меняющейся в течение ряда лет, является международным эталоном ЭДС.
Другим примером простой гальванической цепи (без переноса) является Элемент Вольта
(–) Zn | H2SO4 | Cu (+).
Оба металлических электрода помещены в один раствор электролита (H2SO4)
Электродные процессы
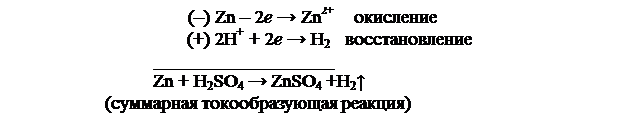
Сложные химические цепи – это цепи с переносом. К ним относится элемент Якоби-Даниэля, принцип работы которого рассмотрен ранее. Разновидностью сложных химических цепей являются окислительно-восстановительные или редокси-цепи. Значение ЭДС Red-Ox цепи служит мерой глубины протекания окислительно-восстановительного процесса. В качестве примера можно привести цепь, имеющую геохимическое значение:
(–) Pt |H2SO3, S2O3–, H+||Fe3+, Fe2+| Pt (+)
Концентрационные цепи.
Известны гальванические элементы, в которых электрическая энергия образуется не за счет окислительно-восстановительной реакции, а за счет различной концентрации (активности) веществ электродов или растворов, в которые опущены электроды из одного и того же металла. Такие гальванические элементы называются концентрационными. В качестве примера можно назвать цепь, составленную из двух цинковых электродов, погруженных в раствор сульфата цинка различной концентрации (активности).
|
|
|
ЭДС концентрационной цепи возникает вследствии различной активности ионов растворов электролитов. Это электрохимические цепи с переносом.
Схема концентрационной цепи имеет вид:
(–) Zn |ZnSO4 (a1) || ZnSO4 (a2)| Zn (+),
причем активность ионов a1 < a2.
Электродные процессы
(–) Zn – 2 e → Zn2+;
(+) Zn2++2 e → Zn.
Электрохимические процессы, протекающие при его работе, сопровождаются переносом ионов от более концентрированного к более разбавленному раствору.
В процессе работы гальванической цепи активность a2 постоянно уменьшается, активность a1 увеличивается. Концентрационная цепь работает до тех пор, пока сравняются активности у анода и катода.
ЭДС концентрационной цепи определяется через разность электродных потенциалов по уравнению:
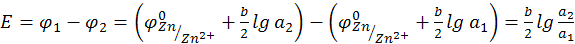 (13.2)
(13.2)
В природе между различными участками рудного тела возникает разность потенциалов (типичные природные проводники – самородные металлы Cu, Ag, Au, Pt; сульфиды, оксиды – эти минералы относятся к полупроводникам). Это приводит к возникновению локальных гальванических элементов, работа которых сопровождается растворением определенных компонентов рудного тела и осаждением других.
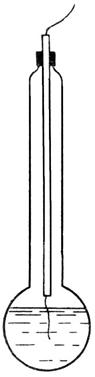 Рис. 13.2
Схема
стеклянного
электрода
Рис. 13.2
Схема
стеклянного
электрода
|
К числу наиболее распространённых приложений прямой потенциометрии, основанной на уравнении Нернста, относятся задачи по определению рН раствора. Основным индикаторным электродом при этом является стеклянный электрод с водородной функцией. В качестве электрода сравнения применяется хлорсеребряный электрод.
Главная часть стеклянного электрода – стеклянный шарик из специального сорта стекла с повышенной проводимостью. Внутри шарика содержится 0,1н раствор HCI и хлорсеребряный электрод миниатюрных размеров. Он служит токоотводом и проводит электроны обратимо во внутренний раствор и из него. Электродный процесс связан с ионным обменом и протекает без участия электронов.
|
|
|
Электрохимическая схема стеклянного электрода

Двойной электрический слой возникает за счет ионообменного процесса стеклянной мембраны и раствора.
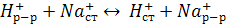 .
.
Различное энергетическое состояние ионов H+ и Na+ в растворе и стекле приводит к тому, что ионы H+ так распределяются между ними, что между поверхностями (внешней и внутренней) мембраны возникает разность потенциалов. Так как pH1=const, то потенциал стеклянного электрода зависит только от pHx внешнего раствора.
 ;
;
или (13.3)
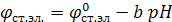 .
.
Основным электродом сравнения является водородный электрод. Его электродный потенциал зависит от концентрации ионов H+ в растворе и давления водорода в газовой фазе. При 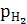 = 1 и Т=298К
= 1 и Т=298К
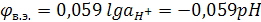 (13.4)
(13.4)
Однако водородный электрод обладает рядом недостатков – он очень чувствителен к “ядам”, отравляющим поверхность платины, к изменению давления. Поэтому в качестве электродов сравнения в практике часто используют другие, менее капризные в работе, электроды сравнения, для которых электродный потенциал хорошо воспроизводим и точно измерен. Измерив потенциал, по отношению к такому электроду, легко рассчитать электродный потенциал исследуемого электрода.
Обычно в качестве электродов сравнения используют каломельный и хлорсеребряный электроды. Потенциалы этих электродов определяются активностью ионов хлора. При температуре 25ºC электродные потенциалы их имеют следующую величину.
| Концентрация KCI, н | Электродный потенциал, В | |
| Каломельный | Хлорсеребряный | |
| 0,1 | +0,3358 | +0,290 |
| 1,0 | +0,2810 | +0,238 |
| насыщенный (≈3,5) | +0,2420 | +0,201 |
Если соединить стеклянный электрод с электродом сравнения (хлорсеребряный, каломельный), то получится гальванический элемент
(–) Ag, AgCI | KCI || HCI | AgCI, Ag (+),
ЭДС которого линейно зависит от pH раствора
 (13.5)
(13.5)
Прежде чем использовать для измерения pH неизвестного раствора, стеклянный электрод калибруют по буферным растворам с известными значениями pH. Достоинствами стеклянного электрода является быстрое установление потенциала, возможность работы в широком интервале значений pH (от 1 до 11) и то, что он не подвержен действию окислителей, восстановителей и веществ, отравляющих поверхность платины в водородном электроде.
|
|
|
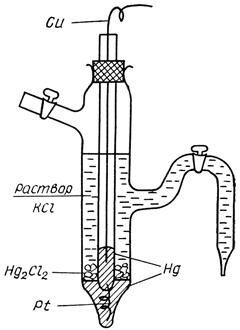 Рис 13.3 Каломельный
электрод
Рис 13.3 Каломельный
электрод
|  Рис. 13.4 Хлорсеребряный
электрод
Рис. 13.4 Хлорсеребряный
электрод
|
Возникновение мембранной разности потенциалов можно использовать для измерения активности (концентрации) ионов. Гальванические элементы такого типа используются, например, при измерении активности ионов водорода, pH и ЭДС со стеклянным электродом.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5114; Нарушение авторских прав?; Мы поможем в написании вашей работы!