
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости химических реакций от температуры
Температуры, краткие сведения о катализе
Лекция 16.Зависимость скорости химических реакций от
Вопросы для самопроверки
1. Рассмотрите кинетические уравнения реакций первого, второго, третьего и нулевого порядков.
2. Какую размерность имеют константы скорости реакций различных порядков?
3. Зависят ли константы скорости реакции первого, второго и третьего порядков от концентрации реагирующих веществ, от времени, температуры?
4. Что называется периодом полураспада и как он зависит от начальной концентрации реагирующих веществ для реакций различных порядков?
5. Какие способы определения порядка реакции вам известны и на чем они основаны?
6. Поясните принцип определения порядка химических реакций графическим способом.
7. Какие численные значения может иметь порядок химических реакций, с чем связаны целочисленные и дробные значения порядка реакции?
16.1 Зависимость скорости химических реакций от температуры.
16.2 Энергия активации, уравнение Аррениуса.
16.3 Способы определения энергии активации.
16.4 Краткие сведения о катализе.
Эксперименты показывают, что с увеличением температуры скорость большинства химических реакций быстро растет (К увеличивается). В случае газовых реакций с увеличением температуры растет число столкновений молекул, что способствует повышению скорости реакции.
Пример: 2Н2+О2→Н2О;
а) При температуре 15-25 ºС реакция протекает очень медленно, поэтому общепринятыми методами ее не удается обнаружить;
б) При температуре 400 ºС реакция продолжается около 80 суток;
в) При температуре 500 ºС реакция завершается за 2 часа;
г) При температуре 600 ºС взаимодействие происходит в форме взрыва (десятитысячные доли секунды).
Этот пример наглядно показывает насколько резко возрастает скорость химической реакции при увеличении температуры.
Голландский ученый Вант-Гофф (1884) на основании наблюдений и анализа существующих данных сформулировал приближённое правило:
При повышении температуры на каждые 10 ºС скорость гомогенной химической реакции увеличивается в 2-4 раза. В математической форме это правило может быть представлено следующим образом:
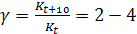 (16.1)
(16.1)
 (16.2)
(16.2)
 (16.3)
(16.3)
где γ – температурный коэффициент Вант-Гоффа.
Это означает, что при увеличении температуры на 100 ºС при γ=2 скорость реакции возрастает в 210 ≈ в 1000 раз, при γ=4 в 410 ≈ 1млн. раз.
Для большинства биохимических реакций γ варьирует от 1,5 до 3. Поэтому, например, если при заболевании температура человеческого тела поднялась от 36,5 до 39,5, то это означает увеличение скорости происходящих биохимических процессов в 1,13−1,39 раз, т.е. на 13−39%.
Правило Вант-Гоффа носит весьма приближенный характер и служит для ориентировочной оценки влияния температуры на скорость реакции. Значение γ часто выходит за пределы 2−4, а для конкретных химических реакций γ может меняться в различных интервалах температур:

Рис. 16.1 Зависимость скорости различных типов реакций от температур:
а) обычная одностадийная реакция;
б) обратимая реакция;
в) ферментативная реакция.
Течение большинства биохимических процессов осуществлялся в температурном интервале 273 … 323К, температурный оптимум у животных еще меньше 308 … 315К.
|
|
Дата добавления: 2014-01-07; Просмотров: 1045; Нарушение авторских прав?; Мы поможем в написании вашей работы!