
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы для самопроверки. 1. Дайте определение коллоидной химии как науки
|
|
|
|
1. Дайте определение коллоидной химии как науки.
2. Рассмотрите типы классификации дисперсных систем, приведите
примеры.
3. Что такое лиофильные и лиофобные коллоидные системы? Какова термодинамическая устойчивость их к коагуляции?
4. Что представляют собой поверхностные явления, происходящие на границе раздела фаз жидкость – газ?
5. Поясните сущность поверхностного натяжения жидкостей. В каких единицах оно выражается?
6. Какими методами может быть измерена величина поверхностного натяжения?
7. Перечислите важнейшие виды собционных процессов. Дайте определение понятий “сорбция”, “абсорбция”, “адсорбция”, “хемосорбция”.
Лекция 18. Адсорбция на границе раздела жидкость-газ
18.1 Поверхностно активные (ПАВ) и инактивные вещества, уравнение Гиббса, анализ, применение.
18.2 Правило Траубе-Дюкло.
18.3 Уравнение Шишковского, применение.
18.4 Поверхностно-активные (ПАВ) и инактивные вещества, уравнение Гиббса, анализ, применение.
Один из простейших случаев адсорбции – это адсорбция на границе раздела жидкость – газ. Растворенные вещества по их влиянию на величину поверхностного натяжения можно разделить на поверхностно-инактивные и поверхностно-активные (ПАВ). Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными. В гетерогенной системе водный раствор – воздух поверхностно-инактивными являются все неорганические электролиты: кислоты, щелочи, соли. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными. Их влияние на поверхностное натяжение воды может быть очень значительно (рис.18.1).
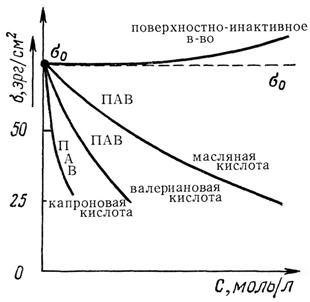
Рис. 18.1 Зависимость σ = f(С) водных растворов
ПАВ являются органические соединения, молекулы которых одновременно содержат полярную группу (–ОН, –СООН, –NH2…) и неполярную углеводородную цепь. Поэтому такие молекулы называются дифилъными, т.е., обладающими двойным сродством одновременно и с полярной, и неполярной фазой. Примером ПАВ в водных растворах могут служить многие органические соединения: жирные кислоты с достаточно длинным углеводородным радикалом, соли этих кислот, сульфокислоты и их соли, аминокислоты, высокомолекулярные спирты, амины. Дифильные молекулы, попадая в воду, стремятся выйти на поверхность раздела фаз, ориентируясь полярными группами в воду, неполярные углеводородные радикалы выталкиваются в воздух, так как сродство их с газообразной фазой больше, чем с водой (рис.18.2). Интенсивность межмолекулярных сил в газе невелика, и поэтому газ или пар условно можно считать неполярной фазой.
|
|
|
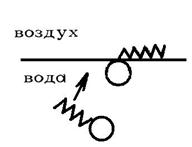
Рис. 18.2. Выход молекулы дифильного вещества
на поверхность раздела фаз.
Концентрируясь на поверхности раздела фаз ПАВ уменьшают σ растворов, т.к. 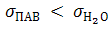 Например,
Например, 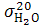 =72,75 эрг/см2,
=72,75 эрг/см2, 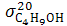 =24,6эрг/см2. Таким образом, самопроизвольное понижение поверхностного натяжения водных растворов ПАВ – следствие их концентрирования на поверхности раздела фаз, т.е. адсорбция.
=24,6эрг/см2. Таким образом, самопроизвольное понижение поверхностного натяжения водных растворов ПАВ – следствие их концентрирования на поверхности раздела фаз, т.е. адсорбция.
Адсорбционное уравнение Гиббса было предложено Гиббсом в 1878 г. и имеет следующий вид:
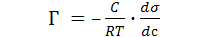 (моль/см2), (18.1)
(моль/см2), (18.1)
где С – концентрация ПАВ (моль/л);
R – универсальная газовая постоянная; 8,32∙107 эрг/моль∙К;
T – абсолютная температура, К;
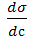 – поверхностная активность вещества (названа по предложению Ребиндера).
– поверхностная активность вещества (названа по предложению Ребиндера).
В честь Гиббса величина −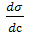 была названа Гиббсом и обозначается буквой G:
была названа Гиббсом и обозначается буквой G: 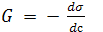
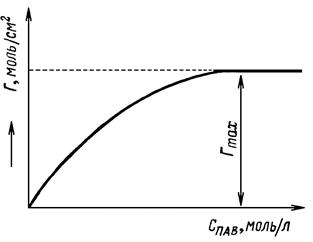
Рис. 18.3 Изотерма адсорбции Гиббса Г – f (Спав)
1) Для растворов ПАВ производная 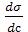 < 0, G > 0, Г > 0 (положительная адсорбция);
< 0, G > 0, Г > 0 (положительная адсорбция);
2) Для растворов поверхностно-инактивированных веществ 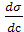 > 0, G<0, Г < 0 (отрицательная адсорбция).
> 0, G<0, Г < 0 (отрицательная адсорбция).
|
|
|
Практически для построения изотермы адсорбции изучают зависимость σ = f (с) и строят изотерму поверхностного натяжения.
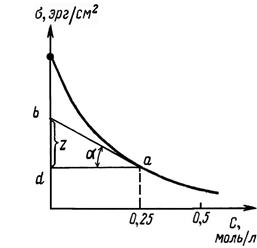
Рис.18.4. Изотерма поверхностного натяжения: s = f (Спав)
Из рисунка видно, что:
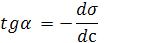

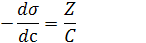
Уравнение Гиббса связывает изотермы поверхностного натяжения σ = f (с) и адсорбции Г = f (с).
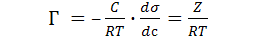 (18.2)
(18.2)
Графический метод построения изотермы адсорбции Гиббса по изотерме поверхностного натяжения дан в лабораторной работе.
При малых концентрациях ПАВ в растворе dC ≈ ΔC ≈ C и уравнение Гиббса имеет вид:
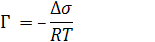
где ∆σ=σ0−σ – поверхностное или двумерное давление.
После определения величины предельной адсорбции Г∞ графическим способам можно рассчитать площадь, приходящуюся на 1 молекулу ПАВ в поверхностном слое S0 и толщину адсорбционного слоя l ∞ по формулам:
 (18.3)
(18.3)
 (18.4)
(18.4)
где N0 – число Авогадро,
М– молярная масса ПАВ,
ρ – плотность ПАВ.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 970; Нарушение авторских прав?; Мы поможем в написании вашей работы!