
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Производство цветных металлов
|
|
|
|
Около 70 элементов таблицы Д. И. Менделеева составляют цветные металлы, без которых немыслимо развитие отраслей промышленности. Цветные металлы широко различаются как по свойствам, так и по способам получения. Так, галлий и цезий имеют температуры плавления 29,8 и 28,5 °С соответственно, т. е. их можно расплавить в руке, а вольфрам плавится при температуре 3400 °С. Литий, имея плотность 0,53 г/см3, не тонет ни в бензине, ни в керосине, а плотность тантала составляет 26,6 г/см3. Для производства цветных металлов применяются пирометаллургия, гидрометаллургия, электролиз, как водных растворов, так и расплавленных солей.
Все цветные металлы делят на 5 групп:
1. Тяжёлые цветные металлы – это металлы, плотность которых превышает 7 г/см3. Типичные представители: медь (8,94 г/см3), никель (8,92 г/см3), свинец (11,34 г/см3), цинк (7,14 г/см3), олово (7,3 г/см3) и др.
2. Легкие цветные металлы – алюминий (2,7 г/см3), магний (1,74 г/см3), кальций (1,55 г/см3), барий (3,75 г/см3), натрий (0,97 г/см3), калий (0,86 г/см3) и др.
3. Благородные металлы – золото, серебро, платина и и металлы платиновой группы.
4. Редкие металлы – это металлы, Кларк которых составляет 10-10 (кларки элементов – числовые оценки среднего содержания химических элементов в земной коре, гидросфере, атмосфере. Введен А. Е. Ферсманом в честь американского геохимика Ф. У. Кларка). Типичные представители этой группы металлов:: титан, индий, рений, галлий, волфрам, литий, молибден и др.
5. Полупроводниковые металлы: селен, мышьяк, сурьма, германий и др.
Следует отметить, что приведенное деление условное. Так, например, титан и литий могут быть отнесены к легким металлам, а практически все полупроводниковые металлы – к редким.
|
|
|
2.1. Производство меди /Кнорозов,, 1974 - с. 69/
Медь — один из важнейших металлов, относится к I – й группе Периодической системы; порядковый номер 29; атомная масса – 63,546; плотность – 8,92 г/см3. температура плавления – 1083 °С; температура кипения – 2595 °С. По электропроводности она несколько уступает лишь серебру и является главным проводниковым материалом в электро- и радиотехнике, потребляющих 40…50 % всей меди. Почти во всех областях машиностроения используются медные сплавы — латуни и бронзы. Медь как легирующий элемент входит в состав многих алюминиевых и других сплавов.
Мировое производство меди в капиталистических странах около 6—7 млн. т, в том числе вторичной меди около 2 млн. т. В СССР выплавка меди за каждое пятилетие увеличивался на 30…40 %.
Медные руды. Медь встречается в природе главным образом в виде сернистых соединений CuS (ковеллин), Cu2S (халькозин) в составе сульфидных руд (85…95 % запасов), реже в виде окисных соединений Сu2О (куприт), углекислых соединений СuСО3 · Сu(ОН)2 - малахит 2СuСО3 · Сu(ОН)2 - азурит и самородной металлической меди (очень редко). Окисные и углекислые соединения трудно поддаются обогащению и перерабатываются гидрометаллургическим способом.
Наибольшее промышленное значение в СССР имеют сульфидные руды, из которых получают около 80 % всей меди. Самыми распространенными сульфидными рудами являются медный колчедан, медный блеск и др.
Все медные руды являются бедными и обычно содержат 1…2 %, иногда меньше 1 % меди. Пустая порода, как правило, состоит из песчаников, глины, известняка, сульфидов железа и т. п. Многие руды являются комплексными — полиметаллическими и содержат, кроме меди, никель, цинк, свинец и другие ценные элементы в виде окислов и соединений.
Примерно 90 % первичной меди получают пирометаллургическим способом; около 10 %—гидрометаллургическим способом.
Гидрометаллургический способ состоит в извлечении меди путем ее выщелачивания (например, слабыми растворами серной кислоты) и последующего выделения металлической меди из раствора. Этот способ, применяемый для переработки бедных окисленных руд, не получил широкого распространения в нашей промышленности.
|
|
|
Пирометаллургический способ состоит в получении меди путем ее выплавки из медных руд. Он включает обогащение руды, ее обжиг, плавку на полупродукт — штейн, выплавку из штейна черной меди, ее рафинирование, т. е. очистку от примесей (рис. 2.1).
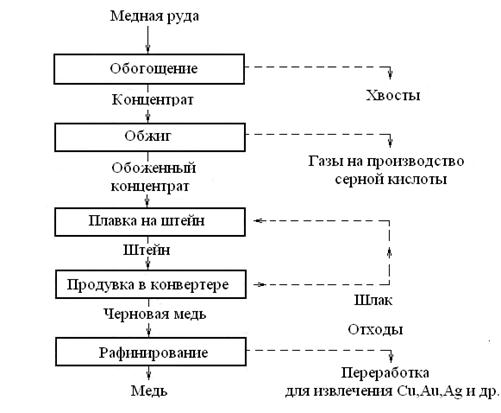
Рис. 2.1. Упрощенная схема пирометаллургического производства меди
Наиболее широко для обогащения медных руд применяется метод флотации. Флотация основана на различном смачивании водой металлсодержащих частиц и частиц пустой породы (рис. 2.2).
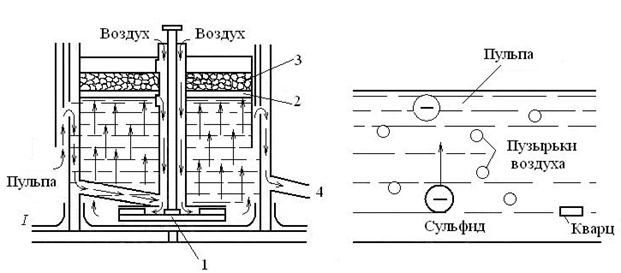
а б
Рис. 2.2. Схема флотации:
а – принципиальная схема механической флотационной машины (вариант);
б – схема всплывания частиц; 1 – мешалка с лопастями; 2 – перегородка;
3 – схема минерализованной пены; 4 – отверстие для удаления хвосты
(пустой породы); I – зона перемешивания и аэрации.
Обогащение медных руд. Бедные медные руды подвергают обогащению для получения концентрата, содержащего 10…35 % меди. При обогащении комплексных руд возможно извлечение из них и других ценных элементов.
В ванну флотационной машины подают пульпу — суспензию из воды, тонкоизмельченной руды (0,05…0,5 мм) и специальных реагентов, образующих на поверхности металлсодержащих частиц пленки, не смачиваемые водой. В результате энергичного перемешивания и аэрации вокруг этих частиц возникают пузырьки воздуха. Они всплывают, извлекая с собой металлсодержащие частицы, и образуют на поверхности ванны слой пены. Частицы пустой породы, смачиваемые водой, не всплывают и оседают на дно ванны.
Из пены фильтруют частицы руды, сушат их и получают рудный концентрат, содержащий 10…35 % меди. При переработке комплексных руд применяют селективную флотацию, последовательно выделяя металлсодержащие частицы различных металлов. Для этого подбирают соответствующие флотационные реагенты.
Обжиг. Рудные концентраты, достаточно богатые медью, плавят на штейн «сырыми» — без предварительного обжига, что снижает потери меди (в шлаке — при плавке, унос — с пылью при обжиге); основной недостаток: при плавке сырых концентратов не утилизируется сернистый газ SO2, загрязняющий атмосферу. При обжиге более бедных концентратов удаляется избыток серы в виде SO2, который используется для производства серной кислоты. При плавке получают достаточно богатый медью штейн, производительность плавильных печей увеличивается в 1,5…2 раза.
|
|
|
Обжиг производят в вертикальных многоподовых цилиндрических печах (диаметр 6,5…7,5 м, высота 9…11 м), в которых измельченные материалы постепенно перемещаются механическими гребками с верхнего первого пода на второй — ниже расположенный, затем на третий и т. д. Необходимая температура (850 °С) обеспечивается в результате горения серы (CuS, Cu2S и др.). Образующийся сернистый газ SO2 направляется для производства серной кислоты.
Производительность печей невысокая — до 300 т шихты в сутки, безвозвратный унос меди с пылью около 0,5 %.
 Новым, прогрессивным способом является обжиг в кипящем слое (рис. 2.3).
Новым, прогрессивным способом является обжиг в кипящем слое (рис. 2.3).
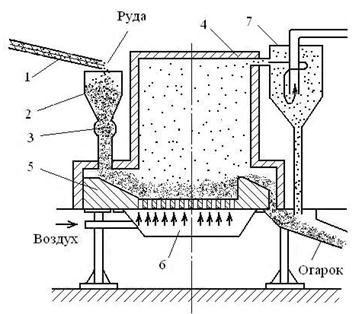
Сущность этого способа состоит в том, что мелкоизмельченные частицы сульфидов окисляются при 600…700 °С кислородом воздуха, поступающего через отверстия в подине печи. Под давлением воздуха частицы обжигаемого материала находятся во взвешенном состоянии, совершая непрерывное движение и образуя «кипящий» («псевдоожиженный») слой. Обожженный материал «переливается» через порог печи. Отходящие сернистые газы очищают от пыли и направляют в сернокислотное производство. При таком обжиге резко повышается интенсивность окисления; производительность в несколько раз больше, чем в многоподовых печах.
Плавка на штейн. Плавку на штейн концентрата наиболее часто проводят в пламенных печах, работающих на пылевидном, жидком или газообразном топливе. Такие печи имеют длину до 40 м, ширину до 10 м, площадь подины до 250 м2 и вмещают 100 т и более переплавляемых материалов. В рабочем пространстве печей развивается температура 1500…1600 °С.
При плавке на подине печи постепенно скапливается расплавленный штейн — сплав, состоящий в основном из сульфида меди Cu2S и сульфида железа FeS. Он обычно содержит 20…60 % Сu, 10…60 % Fe и 20…25 % S. В расплавленном состоянии (t Пл —950…1050 °C) штейн поступает на переработку в черновую медь.
|
|
|
Плавку концентратов производят также в электропечах, в шахтных печах и другими способами. Технически совершенная плавка в электропечах (ток проходит между электродами в слое шлака) нашла ограниченное применение из-за большого расхода электроэнергии. Медные кусковые руды с повышенным содержанием меди и серы часто подвергают медносерной плавке в вертикальных шахтных печах с воздушным дутьем. Шихта состоит из руды (или брикетов), кокса и других материалов. Выплавляемый бедный штейн с 8…15 % Сu обогащают повторной плавкой до 25…4 % Сu, удаляя избыток железа. Эта плавка экономически выгодна, так как из печных газов улавливают до 90 % элементарной серы руды.
Черновую медь выплавляют путем продувки расплавленного штейна воздухом в горизонтальных цилиндрических конверторах (рис. 2.4) с основной футеровкой (магнезит) с массой плавки до 100 т. Конвертор установлен на опорных роликах и может поворачиваться в требуемое положение. Воздушное дутье подается через 40— 50 фурм, расположенных вдоль конвертора.
Через горловину конвертора заливают расплавленный штейн. При этом конвертор поворачивают так, чтобы не были залиты воздушные фурмы. На поверхность штейна через горловину или специальное пневматическое устройство загружают песок — флюс для ошлакования окислов железа, образующихся при продувке. Затем включают воздушное дутье и поворачивают конвертор в рабочее положение, когда фурмы находятся ниже уровня расплава. Плотность штейна (5г/см3) значительно меньше удельного веса меди (8,9 г/см3). Поэтому в процессе плавки штейн доливают несколько раз: пока не будет использована вся емкость конвертора, рассчитанная на выплавляемую медь. Продувка воздухом продолжается до 30 ч. Процесс выплавки черновой меди из штейна делится на два периода.


В первом периоде происходит окисление FeS кислородом воздушного дутья по реакции
2FeS + ЗО2 = 2FeO + 2SO2 + Q.
Образующаяся закись железа FeO ошлаковывается кремнеземом SiO2 флюса:
2FeO + SiO2 = SiO2∙2FeO + Q.
По мере необходимости образующийся железистый шлак сливают через горловину (поворачивая конвертор), доливают новые порции штейна, загружают флюс и продолжают продувку. К концу первого периода железо удаляется почти полностью. Штейн состоит в основном из Cu2S и содержит до 80 % меди.
Шлак содержит до 3 % Сu и его используют при плавке на штейн.
Во втором периоде создаются благоприятные условия для протекания реакций
2Cu2S + ЗО2 = 2Cu2O + 2SO2 +Q;
Cu2S + 2Cu2O = 6Cu + SO2 — Q,
приводящих к восстановлению меди.
В результате плавки в конверторе получается черновая медь. Она содержит 1,5…2 % примесей (железа, никеля, свинца и др.) и не может быть использована для технических надобностей. Плавку меди выпускают из конвертора через горловину, разливают на разливочных машинах в слитки (штыки) или плиты и направляют на рафинирование.
Рафинирование меди — ее очистку от примесей — проводят огневым и электролитическим способом.
Огневое рафинирование ведут в пламенных печах емкостью до 400 т. Его сущность состоит в том, что цинк, олово и другие примеси легче окисляются, чем сама медь, и могут быть удалены из нее в виде окислов. Процесс рафинирования состоит из двух периодов — окислительного и восстановительного.
В окислительном периоде примеси частично окисляются уже при расплавлении меди. После полного расплавления для ускорения окисления медь продувают воздухом, подавая его через погруженные в жидкий металл стальные трубки. Окислы некоторых примесей (SbO2, PbO, ZnO и др.) легко возгоняются и удаляются с печными газами. Другая часть примесей образует окислы, переходящие в шлак (FeO, Аl2Оз, Si02). Золото и серебро не окисляются и остаются растворенными в меди.
В этот период плавки происходит также и окисление меди по реакции 4Cu+O2=2Cu2O.
Задачей восстановительного периода является раскисление меди, т. е. восстановление Сu20, а также дегазация металла. Для его проведения окислительный шлак полностью удаляют. На поверхность ванны насыпают слой древесного угля, что предохраняет металл от окисления. Затем проводят так называемое дразнение меди. В расплавленный металл погружают сначала сырые, а затем сухие жерди (шесты). В результате сухой перегонки древесины выделяются пары воды и газообразные углеводороды, они энергично перемешивают металл, способствуя удалению растворенных в нем газов (дразнение на плотность).
Газообразные углеводороды раскисляют медь, например, по реакции 4Cu2O+CH4=8Cu+CO2+2H2O (дразнение на ковкость). Рафинированная медь содержит 0,3…0,6 % Sb и других вредных примесей, иногда до 0,1 % (Au+Ag).
Готовую медь выпускают из печи и разливают в слитки для прокатки или в анодные пластины для последующего электролитического рафинирования. Чистота меди после огневого рафинирования составляет 99,5 … 99,7 %.
Электролитическое рафинирование обеспечивает получение наиболее чистой, высококачественной меди. Электролиз проводят в ваннах из железобетона и дерева, внутри футерованных листовым свинцом или винипластом. Электролитом служит раствор сернокислой меди (CuSO4) и серной кислоты, нагретый до 60…65 °С, Анодами являются пластины размером 1х1 м толщиной 40…50 мм, отлитые из рафинируемой меди. В качестве катодов используют тонкие листы (0,5…0,7 мм), изготовленные из электролитической меди.
Аноды и катоды располагают в ванне попеременно; в одной ванне помещают до 50 анодов. Электролиз ведут при напряжении 2…3 В и плотности тока 100… 150 А/м2.
При пропускании постоянного тока аноды постепенно растворяются, медь переходит в раствор в виде катионов Си2+. На катодах происходит разрядка катионов Cu2++2e → Cu и выделяется металлическая медь.
Анодные пластины растворяются за 20…30 суток. Катоды наращивают в течение 10…15 суток до массы 70…140 кг, а затем извлекают из ванны и заменяют новыми.
При электролизе на катоде выделяется и растворяется в меди водород, вызывающий охрупчивание металла. В дальнейшем катодную медь переплавляют в плавильных печах и разливают в слитки для получения листов, проволоки и т. п. При этом удаляется водород. Расход электроэнергии на 1 т катодной меди составляет 200…400 кВт · ч. Электролитическая медь имеет чистоту 99,95 %. Часть примесей оседает на дне ванны в виде шлама, из которого извлекают золото, серебро и некоторые другие металлы.
2.2. Производство алюминия /Солнцев, МиТКМ, с.44 /
В группу легких металлов, имеющих плотность меньше 5 г/см, входят Al, Mg, Ti, Be, Ca, В, Zn, К и др. Наибольшее промышленное применение из них имеют алюминий, магний, титан.
Алюминий является самым распространенным металлом в земной коре. Он преимущественно встречается в виде соединений с кислородом и кремнием алюмосиликатов. Для получения алюминия используют руды, богатые глиноземом AI2O3. Чаще всего применяют бокситы, в которых содержится, %: Аl2О3 40—60, Fе2О3 15—30,SiO25—15,ТiO22—4 и гидратной влаги 10—15.
Технологический процесс производства алюминия состоит из трех этапов: извлечение глинозема из алюминиевых руд, электролиз расплавленного глинозема с получением первичного алюминия и его рафинирование. Извлечение глинозема обычно производят щелочным способом, применяемым в двух вариантах: мокром (метод Байера) и сухом.
При мокром методе бокситы сушат, измельчают и загружают в герметические автоклавы с концентрированной щелочью, где выдерживают в течение 2—3 ч при температуре 150…250 °С и давлении до 3 МПа. При этом протекают реакции взаимодействия гидрооксида алюминия с едким натром:
AI2O3 + ЗН2О + 2NaOH=Na2O AI2O3 + 4Н2О.
Раствор алюмината натрия Nа2О· А12О в виде горячей пульпы идет на дальнейшую переработку. Оксиды железа, титана и другие примеси, не растворяющиеся в щелочах, выпадают в осадок-шлам.
Кремнезем также взаимодействует со щелочью и образует силикат натрия: SiO2 + 2NaOH = Na2O SiO2 + 4Н2О, который, в свою очередь, взаимодействуя с алюминатом натрия, выпадает в осадок, образуя нерастворимое соединение Na2O· AI2O3 ·2SiO2·2Н2О.
Пульпа после фильтрации и разбавления водой сливается в отстойник, где из алюминатного раствора выпадает в осадок гидроксид алюминия:
Na2O· AI2O3 + 4Н2О = 2NaOH + 2A1 (ОН)3.
Гидроксид алюминия фильтруют и прокаливают при температуре до 1200 °С в трубчатых вращающихся печах. В результате получается глинозем:
2А1(ОН)3= AI2O3 + ЗН2О.
Сухой щелочной способ или способ спекания состоит в совместном прокаливании при температурах 1200…1300 °С смеси боксита, соды и извести, приводящем к образованию спека, в котором содержится водорастворимый алюминат натрия:
AI2O3 + Nа2СО3=Na2O · AI2O3 + СО2.
Известь расходуется на образование нерастворимого в воде силиката кальция СаО • SiO2. Алюминат натрия выщелачивают из спека горячей водой и полученный раствор продувают углекислотой:
Na2O AI2O3 + ЗН2О + СО2=2А1(ОН)3 +Nа2СО3.
Осадок промывают и прокаливают, получая глинозем, как и в предыдущем способе.
Алюминий получают электролизом глинозема, растворенного в расплавленном криолите Na3AlF6. Этот метод был предложен в 1886 г. одновременно Ч.Холлом в США и П.Эру во Франции и применяется до сих пор почти без изменений. Криолит получают в результате взаимодействия плавиковой кислоты HF с гидроксидом алюминия с последующей нейтрализацей содой:6HF + А1(ОН)3=Н3АlF6 + ЗН2О;
H3AIF6 + ЗNа2СО3=2Na3AlF6 + ЗН2О + СО2-
Электролиз осуществляют в алюминиевой ванне-электролизере, схема которого приведена на рис. 2.5.
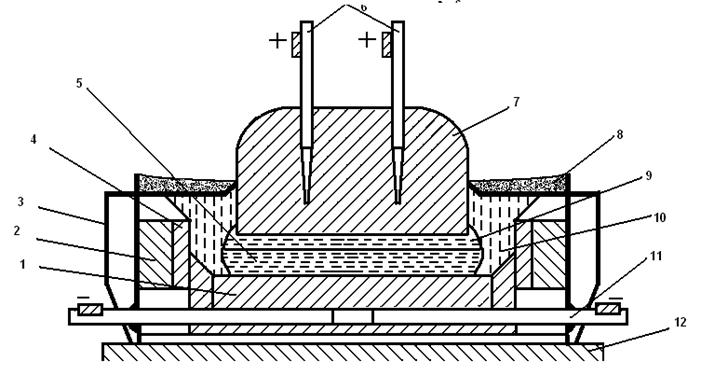
Рис. 2.5. Схема электролизера для производства алюминия:
1 — катодные угольные блоки; 2 — огнеупорная футеровка; 3 — стальной кожух; 4 — угольные плиты; 5 — жидкий алюминий; 6 — металлические стержни с шинами; 7 — угольный анод; 8 — глинозем; 9 — жидкий электролит; 10 — корка затвердевшего электролита; 11 — катодная токо-подводящая шина; 12 — фундамент
Ванна имеет стальной кожух прямоугольной формы, а ее стену и подину изготавливают из угольных блоков, теплоизолированных шамотным кирпичом. В футеровку подины вмонтированы стальные катодные шины, благодаря чему угольный корпус ванны является катодом электролизера. Анодами служат самообжигающиеся, вертикально расположенные угольные электроды, погруженные в расплав. При электролизе аноды постепенно сгорают и перемещаются вниз. По мере сгорания они наращиваются сверху жидкой анодной массой, из которой при нагреве удаляются летучие и происходит ее коксование. Электролит нагревается до рабочей температуры 930—950 °С. Глинозем, расходуемый в процессе электролиза, периодически загружают в ванну сверху. Благодаря охлаждению воздухом на поверхности образуется корка электролита. На боковой поверхности ванны образуется затвердевающий слой электролита (гарнисаж), предохраняющий футеровку от разрушения и теплоизолирующий ванну.При высокой температуре глинозем AI2O3, растворенный в электролите, диссоциирует на ионы: А12О3=2А13++ O2- На поверхности угольной подины, являющейся катодом, ионы восстанавливаются до металла: 2Al3++6e=2al
По мере уменьшения содержания глинозема в электролите его периодически загружают в ванну электролизера. Жидкий алюминий скапливается на подине электролизера и периодически удаляется с помощью вакуумных ковшей.
Кислородные ионы разряжаются на угольном аноде: 3O2— 6e= 3/2O2, окисляют анод, образуя СО и СО2, которые удаляются вентиляционными устройствами. Электролизные ванны соединяют последовательно в серии из 100—200 ванн.
Первичный алюминий, полученный в электролизной ванне, загрязнен примесями Si, Fe, неметаллическими включениями (AI2O3,С), а также газами, преимущественно водородом. Для очистки алюминия его подвергают рафинированию либо хлорированием, либо электролитическим способом.
Более чистый алюминий получают электролитическим рафинированием, где электролитом являются безводные хлористые и фтористые соли. В расплавленном электролите алюминий подвергают анодному растворению и электролизу. Электролитическим рафинированием получают алюминий чистотой до 99,996 %,потребляемый электрической, химической и пищевой промышленностью. Еще более чистый алюминий(99,9999 %)можно получить зонной плавкой. Этот способ дороже электролиза, мало производителен и применяется для изготовления
небольших количеств металла в тех случаях, когда необходима особая чистота, например для производства полупроводников.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5824; Нарушение авторских прав?; Мы поможем в написании вашей работы!