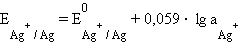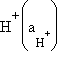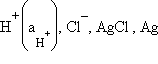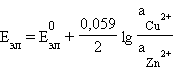КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимия
|
|
|
|
Количественные характеристики реакции гидролиза
Реакции обмена, сопровождаемые гидролизом
Гидролиз по катиону и аниону
Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону и по аниону:
CH3COONH4 + H2O «CH3COOH + NH4OH
или в ионной форме:
CH3COO- + NH4+ + H2O «CH3COOH + NH4OH
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота.
Реакция среды в этом случае зависит от сравнительной силы основания и кислоты, т.е. от их констант диссоциации (KD).
Если KD(основания) > KD(кислоты), то pH > 7;
если KD(основания) < KD(кислоты), то pH < 7.
В случае гидролиза CH3COONH4:
KD(NH4OH) = 6,3 • 10-5; KD(CH3COOH)=1,8 • 10-5
поэтому реакция водного раствора этой соли будет слабощелочной, почти нейтральной (pH = 7–8).
Если основание и кислота, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то в этом случае гидролиз соли протекает необратимо:
Al2S3 + 6H2O «2Al(OH)3¯ + 3H2S
Поэтому сульфид алюминия не может существовать в виде водных растворов, может быть получен только "сухим способом", например, из элементов при высокой температуре:
2Al + 3S –t°® Al2S3
и должен храниться в герметических сосудах, исключающих попадание влаги.
К числу таких реакций относятся взаимодействия солей двухвалентных катионов (кроме Ca2+, Sr2+, Ba2+) с водными растворами карбонатов натрия или калия, сопровождающиеся образованием осадков менее растворимых основных карбонатов
2Cu(NO3)2 + 2Na2CO3 + H2O ® Cu2(OH)2CO3¯ + 4NaNO3 + CO2
А также реакции взаимодействия солей Al3+, Cr3+ и Fe3+ (*При взаимодействии водных растворов солей трёхвалентного железа с сульфидами щелочных металлов протекает окислительно-восстановительная реакция: 2Fe3+ + S2- ® 2Fe2+ + S0) с водными растворами карбонатов и сульфидов щелочных металлов:
|
|
|
2AlCl + 3Na2CO3 + 3H2O ® 2Al(OH)3¯ + 3CO2 + 6NaCl
Cr2(SO4)3 + 3Na2S + 6H2O ® 2Cr(OH)3¯ + 3H2S + 3Na2SO4
Степень гидролиза (aгидр.) - отношение числа гидролизованных молекул к общему числу растворённых молекул (выражается в процентах):
aгидр. = ([C]гидр. / [C]раств.) • 100%
Степень гидролиза зависит от химической природы образующейся при гидролизе кислоты (основания) и будет тем больше, чем слабее кислота (основание) (в определённых равных условиях).
Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод window.top.document.title = "7.2. Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод";
Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка – представляет собой сосуды, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода *), представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС).
*) В проводниках второго рода носителями заряда служат ионы, в отличие от электронов в проводниках первого рода.
Реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля–Якоби, схема которого
|
|
|
|
отражает современную систему обозначений для гальванических элементов. Слева записывается анод Zn¦Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Cu2+¦Cu – электрод с недостатком электронов, положительный полюс (+). Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.

|
| Гальванический элемент Даниэля–Якоби. |
Электроны по внешнему участку цепи, металлическому проводнику, переходят от отрицательного полюса к положительному. Внешнюю цепь на схеме не изображают. В круглых скобках знаками плюс и минус обозначают полюсы электродов.
Рассмотрим системы металл–растворитель и металл–электролит. В этих гетерогенных системах в зависимости от природы металла и электролита возможен переход ионов металла в раствор или ионов металла из раствора на поверхность металла. Эти процессы определяются отношением энтальпии отрыва иона от кристаллической решетки металла (ΔHреш) и энтальпии сольватации этого иона Mn+ ∙ solv(ΔHsolv).
В результате на фазовой границе металл–электролит устанавливается равновесие:
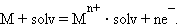
|
Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо, что приводит к отрицательному заряду на металле по отношению к раствору. Если малоактивный металл погружен в раствор соли с концентрацией больше равновесной, то происходит переход ионов из раствора на металл, заряженный положительно. В любом случае возникает двойной электрический слой, и появляется разность электрических потенциалов, или гальвани-потенциал.
Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды в электрохимии – это системы из двух токопроводящих тел: проводников 1 и 2 рода. Абсолютное значение разности потенциалов на границе двух фаз разной природы металл│электролит измерить нельзя, однако можно измерить разность потенциалов двух различных электродов.

|
| Схема двойного электрического слоя (а) и (б); распределение заряда в объеме электролита (в). |
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K
|
|
|
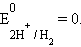
|
Платиновая чернь адсорбирует водород, который электрохимически взаимодействует с H+ по уравнению

|
Для гальванического элемента
| (–)Pt, H2¦2H+||Mn+¦M(+), |
в котором протекает окислительно-восстановительная реакция

|
запишем уравнение изотермы
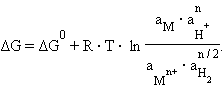
|
Учитывая, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а ΔG = –nFE, после преобразования получим уравнение Нернста для электродного процесса:
| (7.1) |
В этом уравнении 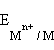 – ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея.
– ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея.
Уравнение (7.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода.
Отметив, что  – активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
– активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
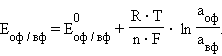
|
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста:
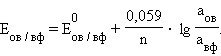
|
Активность твердого вещества (aтв) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода (aM) уравнение Нернста упрощается:
|
Потенциал электрода, как видно из этого уравнения, зависит от активности ионов  которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E0.
которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E0.
|
|
|
Следует подчеркнуть, что:
1. Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная.
2. В дробном индексе при E и E0 над чертой ставится окисленная форма полуэлемента, под чертой – восстановленная.
3. Активности твердых веществ в уравнение Нернста не входят.
Значения некоторых стандартных окислительно-восстановительных потенциалов гальванических элементов, расположенных в порядке их возрастания, представлены в таб.ниже.
Положительный окислительно-восстановительный потенциал электрода Cu2+│Cu (E0 = +0,34 B) показывает, что в стандартных условиях водород окисляется ионами меди, медный электрод по отношению к водороду является катодом, электроны по внешней цепи переходят от водорода к меди:

|
Отрицательный потенциал Zn2+│Zn (E0 = 0,76 B) означает, что в стандартных условиях цинковый электрод может быть только анодом, его окислительные функции по отношению к водородному электроду 2H+│H2 отрицательные. Цинк здесь восстанавливает катионы водорода, электроны во внешней цепи перетекают от цинка к водороду:

|
Суммируя эти реакции, получим
|
то есть электрод с более положительным значением стандартного электродного потенциала является окислителем по отношению к электроду с менее положительным значением E0.
Стандартные окислительно-восстановительные потенциалы window.top.document.title = "7.2.1. Стандартные окислительно-восстановительные потенциалы";
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартные окислительно-восстановительные потенциалы. |
Классификация электродов window.top.document.title = "7.3. Классификация электродов";
Многочисленные ХИТ могут быть составлены из двух электродов (полуэлементов, электродных пар). По типу потенциалопределяющей реакции (окислительно-восстановительного электродного процесса) электроды делят на электроды первого рода, второго рода (электроды с электрохимической реакцией) и ионоселективные (без электрохимической реакции) (рис. 7.3).

|
| Рисунок 7.3. Классификация равновесных (обратимых) электродов. |
Электроды первого рода window.top.document.title = "7.3.1. Электроды первого рода";
К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов.
Электродами первого рода являются:
1. Электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы.
а) Металлический электрод – металл, погруженный в раствор своей соли M|Mn+, например, цинковый и медный электроды:
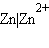
| 
|

| 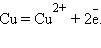
|
Металлический электрод обратим по отношению к катиону. Его электродный потенциал
|
б) Газовый электрод в качестве одного из компонентов электродной пары содержит газ (H2, Cl2 и др.), адсорбированный на химически инертном проводнике первого рода (обычно платина, покрытая платиновой чернью). При контакте адсорбированного газа с раствором собственных ионов устанавливается равновесие. Для хлорного и водородного электродов это равновесие можно представить уравнениями:

|

|
Соответствующие им уравнения Нернста имеют вид:

|

|
Очевидно, что их электродный потенциал зависит от давления и активности (концентрации) ионов в растворе.
2. Редокс-электроды состоят из электрохимически инертного проводника (платины, графита и т. д.), погруженного в раствор, в котором находятся окисленная и восстановленная формы потенциалопределяющего вещества. Такой инертный проводник способствует передаче электронов от восстановителя к окислителю через внешнюю цепь. Примерами таких электродов могут служить редокс-электроды с ионами в различных степенях окисления: (Pt)Sn4+, Sn2+, (Pt)Fe3+, Fe2+.
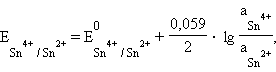
|
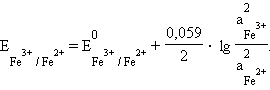
|
Электроды второго рода window.top.document.title = "7.3.2. Электроды второго рода";
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl– представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
Серебро электрохимически взаимодействует со своим ионом:
| Ag+ + ē = Ag. |
Уравнение Нернста для этого процесса:
|
Однако в присутствии труднорастворимого AgCl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag+ связана с легко задаваемой в данной системе активностью ионов Cl– произведением растворимости хлорида серебра ПРAgCl:
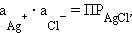
|
откуда
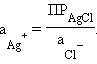
|
Подставляя это выражение в (7.2)

|
и обозначив
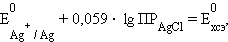
|
получим уравнение Нернста для хлорсеребряного электрода:
|
Потенциалопределяющими являются ионы хлора, а электродный процесс может быть представлен уравнением
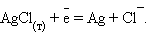
|
б) Каломельный электрод (КЭ) Hg, Hg2Cl2|Cl– – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Принцип действия каломельного электрода тот же, что и хлорсеребряного.
Электродная реакция сводится к восстановлению каломели до металлической ртути:

|
Потенциал каломельного электрода определяется активностью ионов хлора:
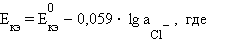 
|
Ионоселективные электроды window.top.document.title = "7.3.3. Ионоселективные электроды";
Ионоселективные электроды (ИСЭ), чувствительные к катионам и анионам, представляют собой электрохимические системы, в которых потенциал определяется процессами распределения ионов между мембраной и раствором.
| ||||||
| Таблица 7.2. |
Мембрана разделяет два раствора (исследуемый и стандартный), содержащие ионы, способные проникнуть в мембрану и двигаться в ней. Стандартный раствор содержит только один вид мембраноактивных ионов A+. Состав стандартного раствора неизменен. В настоящее время широко применяются ИСЭ с четко выраженной избирательностью к большому числу катионов и анионов.
Наиболее распространенными ИСЭ являются стеклянные электроды. Стекло рассматривается как твердый электролит, способный вступать в ионное взаимодействие с раствором. Стекла, содержащие катионы Na, Li, Ca, обладают сродством к ионам H+, введением в состав стекла оксидов Al и B удалось создать ИСЭ для ионов Na+, K+, 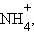 Li+, Ag+, Tl+ и др.
Li+, Ag+, Tl+ и др.
Стеклянный электрод для определения концентрации H+ состоит из стеклянного тонкостенного шарика, припаянного к стеклянной трубке. В шарик налит раствор HCl (внутренний раствор, 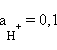 моль∙л–1), в который опущен хлорсеребряный электрод. При погружении стеклянного электрода в раствор с измеряемой концентрацией H+ (внешний раствор) между мембраной и исследуемым раствором (р) происходят процессы ионного обмена:
моль∙л–1), в который опущен хлорсеребряный электрод. При погружении стеклянного электрода в раствор с измеряемой концентрацией H+ (внешний раствор) между мембраной и исследуемым раствором (р) происходят процессы ионного обмена:

|
приводящие к разности потенциалов.
| ||||||||
| Таблица 7.3. |
Потенциал стеклянного электрода равен
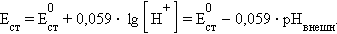
|
Стеклянные электроды обычно используют для определения pH.
Водородный электрод, выбранный за нулевую точку при сравнении электродных потенциалов, в качестве рабочего электрода сравнения практически не используется. Это связано со многоми конструкциоными, технологическими и эксплуатационными трудностями: газообразный водород очень критичен даже к малейшим примесям, его давление должно строго соответствовать 100 кПа, а активность ионов водорода в растворе – строго соответствовать единице, поверхность платинового электрода должна быть чистой и сохранять каталитические свойства в течение долгого времени. Поэтому в качестве электродов сравнения обычно используют лишенные этих неудобств электроды второго рода; чаще других хлорсеребряный (ХСЭ) и каломельный (КЭ), так как при постоянной концентрации ионов хлора их потенциалы остаются постоянными. Кроме ХСЭ и КЭ очень удобным в работе оказался стеклянный электрод.
Если гальванический элемент составлен из полуэлементов сравнения, то он обладает высокой стабильностью, его ЭДС не меняется многие годы.
Химические источники тока window.top.document.title = "7.4. Химические источники тока";
Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов (анод), а другой их принимает (катод). В гальванических элементах источником электрического тока является химическая реакция. Любая химическая реакция термодинамически разрешена, если ΔG < 0. Из соотношений ΔG = –nFE и ΔG0 = –nFE0 следует, что электрохимическая реакция, а в общем случае любая окислительно-восстановительная реакция может протекать самопроизвольно, если E > 0 или для стандартных условий E0 > 0.
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).

|
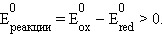
|
Пользуясь этими соотношениями и таблицей стандартных электродных потенциалов, можно предсказать возможность осуществления многих окислительно-восстановительных реакций.
В случае элемента Даниэля–Якоби (–)Zn¦Zn2+||Cu2+¦Cu(+)
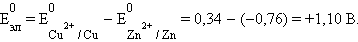
|
Для нестандартных условий ЭДС элемента Даниеля–Якоби находится из разности электродных потенциалов, вычисленных по уравнению Нернста:
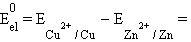
|

|
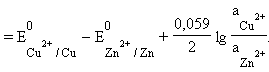
|
|
Для реакции
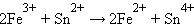
|

|

|
осуществляемой в элементе

|
| (7.3) |
Величины электродных потенциалов определяются концентрациями (активностями) всех ионов, участвующих в окислительно-восстановительной реакции. Так, в элементе
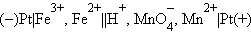
|
протекает реакция
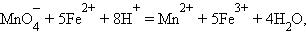
|
 
|
и уравнение Нернста для этого элемента имеет вид:
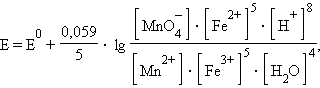
|
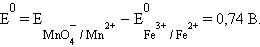
|
Обратите внимание, что в уравнении Нернста для реакции под знаком логарифма в числителе стоят концентрации исходных веществ, а в знаменателе – продуктов реакции в степенях стехиометрических коэффициентов.
Итак, сопоставляя электродные потенциалы соответствующих систем, можно заранее определить направление, в котором будет протекать окислительно-восстановительная реакция при любых (нестандартных) условиях. Окисленная форма вещества с более высоким потенциалом является окислителем для восстановленных форм с более низким потенциалом.
Однако в большинстве случаев о направлении реакции можно судить по разности стандартных электродных потенциалов  –
– 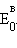 В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
Равновесное состояние любой окислительно-восстановительной реакции характеризуется нулевой ЭДС (ΔGравн = 0). Тогда из уравнения (7.3) следует

|
то есть представляется возможность определить константу равновесия из электрохимических данных.
При
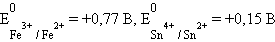
|
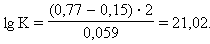
|
Следовательно, реакция 2Fe3+ + Sn2+ = 2Fe2+ + Sn4+ будет самопроизвольно протекать слева направо, поскольку константа равновесия ее очень велика (K = 1 ∙ 1021).
В общем виде связь ЭДС с K выражается уравнением
|
Типы гальванических элементов window.top.document.title = "7.4.1. Типы гальванических элементов";
Концентрационные элементы состоят из одинаковых электродов, отличающихся активностями потенциалопределяющего иона  Действительно, из уравнения Нернста следует, что при a1 > a2 ЭДС концентрационного элемента
Действительно, из уравнения Нернста следует, что при a1 > a2 ЭДС концентрационного элемента
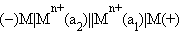
|
равна

|
ЭДС этих элементов обычно очень мала. Концентрационные элементы используются при определении pH и концентраций труднорастворимых солей.
В топливных гальванических элементах (электрохимических генераторах) процесс окисления некоторых видов топлива используется для непосредственного получения электрической энергии. Основным их преимуществом является принципиальная возможность достижения очень высоких КПД использования топлив.
В щелочном водородно-кислородном топливном элементе
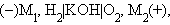
|
где M1 и M2 – проводники первого рода, в основном серебро, металлы платиновой группы и некоторые другие, играющие роль катализаторов электродных процессов и токоотводов, на аноде идет реакция

|
а на катоде –
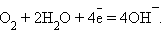
|
Суммарный процесс соответствует реакции горения водорода:

|
Батарея топливных элементов с устройствами для подвода топлива и окислителя, вывода продуктов реакции, поддержания и регулирования температуры, называется электрохимическим генератором. Кислородно-водородные генераторы применяются на космических кораблях. Они обеспечивают космический корабль и космонавтов не только энергией, но и водой, которая является продуктом реакции в топливном элементе.
Аккумуляторами называются обратимые гальванические элементы многоразового действия. При пропускании через них электрического тока (зарядке) они накапливают химическую энергию, которую потом при их работе (разрядке) отдают потребителю в виде электрической энергии. Наиболее распространены два вида аккумуляторов: кислотный (свинцовый) и щелочные.
Анод заряженного свинцового аккумулятора состоит из свинца, катод – из диоксида свинца. Металлический тип проводимости PbO2 делает его пригодным для работы в качестве электрода. Электролитом служит раствор H2SO4 (32–39 %), в котором PbSO4 и PbO2 малорастворимы.
Схему аккумулятора можно изобразить так:
|
Анодный процесс работающего аккумулятора

|
катодный процесс –

|
Таким образом, в свинцовом аккумуляторе осуществляется реакция
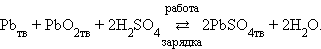
|
При зарядке протекает обратная реакция и электроды меняют свои функции: катод становится анодом, а анод – катодом. ЭДС свинцового аккумулятора зависит от отношения активности кислоты и воды:

|
В процессе работы аккумулятора концентрация кислоты падает, а следовательно, падает и ЭДС. Когда ЭДС достигает 1,85 В, аккумулятор считается разрядившимся. При более низкой ЭДС пластины покрываются тонким слоем PbSO4 и и аккумулятор разряжается необратимо. Во избежание этого аккумулятор периодически подзаряжают.
В заряженном щелочном железо-никелевом аккумуляторе анодом служит железо, катодом – гидроксид никеля (III), электролит – 20%-й раствор KOH:
|
При работе аккумулятора на аноде происходит окисление железа:

|
на катоде – восстановление гидроксида никеля (III):
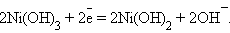
|
Суммарная активность процесса:
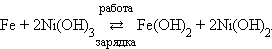
|
В уравнении Нернста для данного аккумулятора под знаком логарифма стоят не концентрации, а произведения растворимости ПР участвующих в этой реакции труднорастворимых веществ:
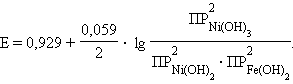
|
ЭДС щелочного аккумулятора не зависит от концентрации щелочи, поскольку в выражение под знаком логарифма входят постоянные величины.
Аналогично работают щелочные кадмий-никелевый и серебряно-цинковый аккумуляторы:

|
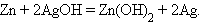
|
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 1078; Нарушение авторских прав?; Мы поможем в написании вашей работы!
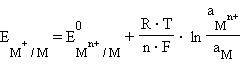
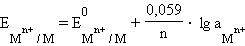
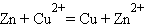
 + H2O
+ H2O
 + 2HO–
+ 2HO–
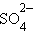 + 2H+
+ 2H+
 + 2H2O
+ 2H2O
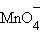
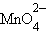
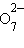 + 14H+
+ 14H+