
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения ванадия в степени окисления +4
|
|
|
|
При обычных условиях степень окисления +4 для ванадия наиболее характерна. Соединения V (III) довольно легко окисляются до производных V (IV) кислородом, а соединения V (V) восстанавливаются до производных V (IV). Координационное число ванадия (IV) равно 6, а также 4 и 5.
Из производных V (IV) известны синий 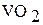 , коричневый
, коричневый  и красно-бурый
и красно-бурый  , а также оксогалогениды типа
, а также оксогалогениды типа  .
.
Оксид ванадия (IV) 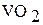 образуется при осторожном восстановлении
образуется при осторожном восстановлении 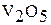 водородом, а тетрахлорид ванадия
водородом, а тетрахлорид ванадия  – при окислении ванадия (или феррованадия) хлором.
– при окислении ванадия (или феррованадия) хлором.
Оксид ванадия (IV) имеет кристаллическую решетку типа рутила  . Молекула
. Молекула  имеет тетраэдрическую форму.
имеет тетраэдрическую форму.
По сравнению с однотипными производными V (II) и V (III), бинарные соединения V(IV) проявляют кислотные свойства более отчетливо. Так, нерастворимый в воде 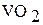 относительно легко взаимодействует при нагревании со щелочами. При этом образуются оксованадаты (IV) бурого цвета, чаще всего состава
относительно легко взаимодействует при нагревании со щелочами. При этом образуются оксованадаты (IV) бурого цвета, чаще всего состава  . Например:
. Например:
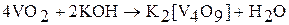
Еще легче 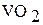 растворяется в кислотах. При этом образуются аквапроизводные оксованадила
растворяется в кислотах. При этом образуются аквапроизводные оксованадила 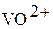 , характеризующиеся светло-синей окраской:
, характеризующиеся светло-синей окраской:
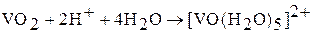
Для V (IV) весьма типичны производные анионных комплексов оксованадила типа  ,
, 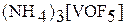 .
.
Тетрагалогениды ванадия легко гидролизуются. Например, в воде  мгновенно переходит в
мгновенно переходит в 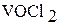 (дихлорид ванадила):
(дихлорид ванадила):
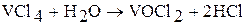
Для ниобия и тантала известны диоксиды  и тетрагалогениды
и тетрагалогениды  . В этих соединениях проявляется связь металл-металл, то есть они относятся к кластерам.
. В этих соединениях проявляется связь металл-металл, то есть они относятся к кластерам.
В табл. 2 приведены кислородные соединений подгруппы ванадия.
Таблица 2
Кислородные соединения элементов V группы побочной подгруппы
| Название | Степень окисления | Оксиды | Гидроксиды | Соли | |||
| Формула | Характер | Формула | Название | Формула иона | Название | ||
| V | +2 | VO | основный | V(OH)2 | Гидроксид ванадия (II) | V2+ | Соли ванадия (II) |
| +3 | 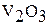
| основный | 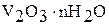
| Гидроксид ванадия (III) | 
| Соли ванадия (III) | |
| +4 | 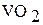
| амфотерный | 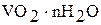
| Гидроксид ванадия (IV) | 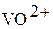
| Соли ванадила | |
| +5 | 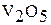
| кислотный | 
| Ванадиевая кислота | 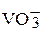
| Ванадаты | |
| Nb | +5 | 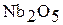
| кислотный | 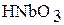
| Ниобиевая кислота | 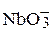
| Ниобаты |
| Ta | +5 | 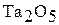
| кислотный | 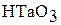
| Танталовая кислота | 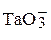
| Танталаты |
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 615; Нарушение авторских прав?; Мы поможем в написании вашей работы!