
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства соединений серы(VI)
|
|
|
|
Оксид серы(VI) SО3 (серный ангидрид) при охлаждении до 44,8 оС конденсируется в бесцветную жидкость, состоящую в основном из циклических тримерных молекул (SО3)3. Ниже 16,8оС жидкий SО3 затвердевает в бесцветную кристаллическую массу, напоминающую лед. Молекула SО3 – имеет форму плоского треугольника (sp2-гибридизация), неполярная, поэтому плохо растворима в воде.
Молекулы SО3 легко полимеризуются в кольца (SО3)3 (льдовидная модификация) или цепочки (SО3)n (асбеcтовидная модификация) различной длины. Способность молекул SО3 объединяться в кольца или полимеры, связана с координационной ненасыщенностью в ней атома серы, который может за счет sp3- и sp3d2-гибридизации орбиталей образовывать по четыре и по шесть σ-связей. Поэтому молекулы SО3 склонны к реакциям присоединения:
SО3 + НС1 = Н[SО3С1] (сильная хлорсульфоновая кислота)
SО3 + NH3 = Н[SО3NН2] (аминсульфоновая кислота)
На воздухе SО3 дымит, так как взаимодействует с парами воды, образуя
мельчайшие капельки серной кислоты (трудноуловимый сернокислотный
туман):
SО3 + Н2О = Н2SО4
Оксид серы(VI) лучше растворяется в серной кислоте, чем в воде:
SО3 + Н2SО4 <=> Н2S2О7 (дисерная кислота)
В результате получается олеум – густая маслянистая жидкость, дымящая на воздухе. Олеум содержащий до 20- 65% избытка SО3, образует с Н2SО4 полисерные кислоты состава Н2SО4 . nSО3, где n = 1 ÷ 3. Для получения концентрированной серной кислоты олеум смешивают с серной кислотой, содержащей некоторое количество воды.
Серная кислота Н2SО4 – бесцветная маслянистая жидкость, смешивается с водой в любых соотношениях, образуя с ней соединения, которые могут быть выделены при охлаждении в виде кристаллогидратов: Н2SО4·Н2О; Н2SО4·2Н2О; Н2SО4·4Н2О. Поэтому концентрированная серная кислота энергично поглощает воду и используется в качестве осушителя газов. Она способна отнимать у веществ химически связанную воду, обугливая их, например, сахар:
|
|
|
С12Н22О11 + Н2SО4 (конц.) = 12 С + Н2SО4·11Н2О
При взаимодействии серной кислоты с водой происходит значительное выделение энергии. В связи с этим для приготовления разбавленных растворов Н2SО4 из концентрированной серной кислоты, следует серную кислоту тонкой струей приливать к воде, а не наоборот, чтобы избежать ее разбрызгивания. Концентрированная серная кислота причиняет сильные ожоги.
В водных растворах серная кислота является сильной двухосновной кислотой. Н2SО4 образует средние соли Na2SО4 (сульфаты) и кислые соли NaНSО4 (гидросульфаты). Большинство сульфатов растворимо в воде. Соли серной кислоты гидролизу не подвергаются. Многие соли серной кислоты содержат кристаллизационную воду и являются кристаллогидратами. Эти соли часто называют купоросами, например, CuSО4·5Н2О – медный купорос; FeSО4·7Н2О – железный купорос. При нагревании они легко теряют кристаллизационную воду:
CuSО4·5Н2О → CuSО4 + 5Н2О
Голубая соль белая соль
Сульфаты щелочных и щелочноземельных металлов не разлагаются даже при сильном нагревании (> 1000 ºC). Безводные сульфаты тяжелых металлов разлагаются при температуре ниже 1000 ºC, с образованием соответствующих оксидов. Для серной кислоты характерно образование двойных солей, называемых квасцами, например, хромовокалиевые квасцы КСr(SО4) 2·12Н2О; алюмокалиевые квасцы КА1(SО4) 2·12Н2О. Качественной реакцией на ионы SО42- в растворе является добавление к нему раствора хлорида бария. В присутствие сульфат-ионов из раствора выпадает белый нерастворимый в кислотах осадок:
Ва2+ + SО42- = ВаSО4↓
Концентрированная серная кислота – сильный окислитель, особенно при нагревании. Окисляет многие неметаллы и металлы:
С + 2 Н2SО4(конц,) = СО2 + SО2 + Н2О
|
|
|
S + 2 Н2SО4(конц,) = 3 SО2 + 2 Н2О
В окислительно-восстановительных реакциях с металлами степень восстановления серной кислоты зависит от активности металла:
4 Mg + 5 Н2SО4 = 4 MgSО4 + H2S + 4 Н2О
2 Аg + 2 Н2SО4(конц,) = Аg2SО4 + SО2 + 2 Н2О
Разбавленная серная кислота окислительных свойств за счет S+6 не проявляет. Металлы, стоящие в электрохимическом ряду металлов до водорода, вытесняют его из разбавленной серной кислоты, если образующаяся соль растворима в кислоте. Металлы, стоящие в ряду напряжений правее водорода, не растворяются в разбавленной серной кислоте.
Mg + Н2SО4(разб.) = MgSO4 + H2↑
Аg + Н2SО4(разб.) ≠
Концентрированная серная кислота в обычных условиях пассивирует некоторые металлы (Fe, Al, Cr, Co, Ni). Поэтому концентрированную серную кислоту перевозят в стальных цистернах. Для серы известны кислоты и соли, содержащие в своем составе пероксогруппу (О – О)2-. Такие кислоты называются пероксокислотами. К ним относятся следующие кислоты серы: Н2SО5 пероксосерная кислота (мононадсерная кислота) и H2S2O8 пероксодисерная кислота (надсерная кислота).
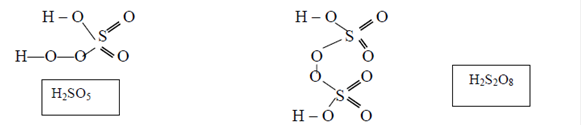
Обе кислоты – бесцветные кристаллические вещества, плавящиеся при нагревании с разложением при температуре 47 оС (Н2SО5) и 65 оС (H2S2O8).
2 Н2SО5 = 2 Н2SО4 + О2
Водород, связанный с пероксогруппой в Н2SО5, на металл не замещается, поэтому для этой кислоты известны только кислые соли КНSО5 (гидропероксомоносульфат калия). Пероксосерные кислоты подвергаются необратимому гидролизу. Гидролиз пероксодисерной кислоты протекает в две стадии:
H2S2O8 + H2O = Н2SО5 + Н2SО4
Н2SО5 + Н2О <=> Н2SО4 + Н2О2
H2S2O8 + 2 Н2О = Н2О2 + 2 Н2SО4
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 2558; Нарушение авторских прав?; Мы поможем в написании вашей работы!