
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства элементов V (15) группы главной подгруппы
|
|
|
|
V группа главная подгруппа
Лекция №3
АЗОТ
План лекции
1. Общая характеристика подгруппы
2. Азот. Нахождение в природе.
3. Методы получения азота
4. Физические и химические свойства азота
5. Соединения азота со степенью окисления –3
6. Получение, физические и химические свойства аммиака
7. Соединения азота со степенью окисления –2
8. Соединения азота со степенью окисления –1
9. Кислородные соединения азота
10. Применение азота и его соединений.
К элементам V (15 по новой номенклатуре ЮПАК) группы главной подгруппы относятся: азот N, фосфор Р, мышьяк As, сурьма Sb, висмут Bi. Общее название элементов V группы главной подгруппы – пниктогены – удушливый, плохо пахнующий.
В основном состоянии атомы пниктогенов имеют электронную конфигурацию внешнего энергетического уровня – …ns2 np3, где n – главное квантовое число (номер периода). Для атомов пниктогенов характерны следующие степени окисления: для азота – (–3, –2, –1, 0, (+1), (+2), +3, (+4), +5); для фосфора – (–3, (–2), 0, (+2), +3, (+4), +5); для мышьяка – (–3, 0, +3, +5); для висмута – ((–3), 0, +3, (+5)).
Для азота характерны все степени окисления от –3 до +5. Для фосфора отрицательные степени окисления менее характерны, чем для азота. Мышьяк и сурьма проявляют преимущественно степени окисления +3 и +5, а висмут, как правило, +3. Высшая степень окисления +5 наиболее устойчива для фосфора и сурьмы. Соединения мышьяка и висмута в степени окисления +5 неустойчивы или вообще не существуют (4f-сжатия обладают слабым экранирующим эффектом).
В табл. 1 представлены основные свойства V (15) группы главной подгруппы.
| Свойство | N | P | As | Sb | Bi |
| Заряд ядра | |||||
| Электронная конфигурация внешнего энергетического уровня в основном состоянии | …2s2 2p3 | …3s2 3p3 | …4s2 4p3 | …5s2 5p3 | …6s2 6p3 |
| Орбитальный радиус, пм | |||||
Энергия ионизации
 , эВ , эВ
| 14,53 | 10,49 | 9,78 | 8,62 | 7,29 |
Энергия сродства к электрону,  , эВ , эВ
| –0,07 | 0,75 | 0,81 | 1,07 | 0,94 |
| Температура плавления, ºС | –210 | 817 (серый, крист) | |||
| Температура кипения, ºС | –195,8 | 615 (субл) | |||
| Электроотрицательность: по Полингу по Оллреду-Рохову | 3,04 3,07 | 2,06 2,06 | 2,18 2,20 | 2,05 1,82 | 2,02 1,67 |
| Энергия связи Э–Э, кДж/моль | |||||
Энергия связи 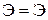 , кДж/моль , кДж/моль
| – | – | – | ||
Энергия связи  , кДж/моль , кДж/моль
|
В V группе главной подгруппе сверху вниз эффективный заряд ядра увеличивается, орбитальный радиус также увеличивается, энергия ионизации уменьшается, восстановительные свойства атомов возрастают.
|
|
|
В V группе главной подгруппе сверху вниз эффективный заряд ядра увеличивается, орбитальный радиус увеличивается, энергия сродства к электрону уменьшается, окислительные свойства атомов уменьшаются.
Атом азота не имеет свободных d-орбиталей, валентные электроны атома фтора (... 2s2 2p3) слабо экранированы от действия ядра, что объясняет небольшой радиус атома азота и высокие значения энергии ионизации и электроотрицательности.
Энергия сродства к электрону у атома азота меньше, чем у атомов фосфора, мышьяка, сурьмы и висмута, что связано с небольшим радиусом атома азота и сильным межэлектронным отталкиванием при присоединении электрона к атому, а также с выгодной электронной конфигурацией внешнего энергетического уровня.
В V группе главной подгруппе сверху вниз энергия ионизации уменьшается, энергия сродства к электрону уменьшается, электроотрицательность уменьшается.
С изменением энергии ионизации свойства пниктогенов изменяются от типичных неметаллов к металлам. Азот и фосфор – типичные неметаллы, сурьма и мышьяк – металлоиды с характерными металлическими свойствами, висмут – металл.
|
|
|
В V группе главной подгруппе сверху вниз температуры плавления и кипения возрастают. Температуры плавления и кипения зависят от величины энергии межмолекулярного взаимодействия. С ростом радиуса атомов межмолекулярное взаимодействие усиливается, что приводит к росту температур плавления и кипения. Азот имеет низкие температуры кипения и плавления, что обусловлено небольшим радиусом атома азота, не полярностью молекулы N2, прочной внутримолекулярной связью.
Понижение температуры плавления в ряду As – Sb – Bi обусловлено увеличением доли металлической связи. Висмут – один из самых легкоплавких металлов.
В ряду P – As – Sb – Bi прочность одинарных δ-связей уменьшается, что объясняется увеличением радиуса атомов пниктогенов сверху вниз и уменьшением перекрывания атомных р-орбиталей. Меньшая прочность связи N – N по сравнению со прочностью связи Р – Р обусловлена небольшим радиусом атома азота и сильным межэлектронным отталкиванием.
В V группе главной подгруппе сверху вниз уменьшается способность к образованию p-связей, что обусловлено увеличением размеров атомов пниктогенов. С увеличением радиуса атома размеры электронных облаков увеличиваются, электронная плотность уменьшается, перекрывание электронных облаков по типу p-связи становится не выгодным.
Энергия двойной (s + p) (432 кДж/моль) и тройной (s + p +p) (946 кДж/моль) связи азота превышает удвоенную (320) и утроенную энергию (480) одинарной связи. Азот имеет тенденцию к образованию двойных и тройных связей.
Для фосфора и мышьяка образование двух и трех одинарных s-связей энергетически более выгодно, чем одной двойной и тройной. Таким образом, для фосфора и мышьяка характерны одинарные связи в различных соединениях с линейной и циклической структурой.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 2752; Нарушение авторских прав?; Мы поможем в написании вашей работы!