
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Карбиды кальция и алюминия подвергаются гидролизу (водному и кислотному):
а) C- окислитель:
1) 4Al + 3C 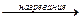 Al4C3
Al4C3
2) Ca + 2C 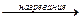 CaC2
CaC2
Карбиды кальция и алюминия подвергаются гидролизу (водному и кислотному):
Al4C3 + 12H2O →4Al(OH)3 + 3CH4
Al4C3 + 12HCl →4AlCl3 + 3CH4 CaC2 + 2H2O → Ca(OH)2 + C2H2
CaC2 + 2HCl → CaCl2 + C2H2.
3) C + 2H2  CH4
CH4
2C + H2  C2H2
C2H2
4) Si + C  SiC (карборунд, вещество, по твердости почти не уступающее алмазу).
SiC (карборунд, вещество, по твердости почти не уступающее алмазу).
б) С – восстановитель: C + O2 → CO2 (в избытке кислорода),
2С + O2 → 2CO (в недостатке кислорода).
Углерод не взаимодействует напрямую с галогенами. Такая реакция возможна только для аморфного углерода и фтора при нагревании: C + F2 = CF4. Остальные галогениды углерода можно получить только косвенным путем, например CS2 + Cl2 = CCl4 + S2Cl2,
Взаимодействие со сложными веществами:
C + H2O «CO + H2 (конверсия угля с водяным паром, получение водорода в промышленности)
С + 2H2SO4 (конц)→ СO2 + 2SO2 + 2H2O (кипячение)
С + 4HNO3 (конц)→ СO2 + 4NO2 + 2H2O (кипячение)
Взаимодействие с оксидами металлов:
*СaO + 3C 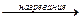 CaC2 + CO
CaC2 + CO
*2Al2O3 + 9C 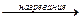 Al4C3 + 6CO.
Al4C3 + 6CO.
С оксидами активных металлов углерод диспропорционирует, менее активные металлы (железо, медь, цинк, свинец) восстанавливает до свободных металлов при нагревании:
2CuO + C → 2Cu + CO2 2PbO + C → Pb + CO2 Примечание: при восстановлении металлов из оксидов может образовываться как CO, так и CO2. Если реакция протекает при температуре более 10000С, то образуется CO, если менее, то CO2.
Взаимодействие с солями: 2С + Na2SO4  Na2S + 2CO2 BaSO4 + 2C
Na2S + 2CO2 BaSO4 + 2C  BaS + 2CO2.
BaS + 2CO2.
Оксиды углерода.
| CO | CO2 |
| Получение: | |
| В промышленности в газогенераторных печах: C + O2 → CO2 (внизу генератора), СO2 + C → 2CO – по мере продвижения CO2 вверх он соприкасается с раскаленным углем Примечание: можно так 2С + О2 = 2СО | CaCO3 + 2HCl → CaCl2 + CO2 + H2O+ 2H2SO4 (конц)→ СO2 + 2SO2 + 2H2O В промышленности при обжиге известняка: CaCO3→ CaO + CO2 |
| Химические свойства | |
| СO + H2O «CO2 + H2 | CO2 + H2O«H2CO3 |
| NiO + CO → Ni + CO2 (нагревание) | CaO + CO2 → CaCO3 |
| *Fe + 5CO → [Fe(CO)5] – карбонил железа | *Mg + CO2 →2MgO + C (магний горит в атмосфере углекислого газа) * 5Сa + 2CO2 →CaC2 + 4CaO |
| 2CO + O2 →2CO2 | CO2 + C →2CO (10000C) |
(для 11 класса)
CO + NaOH  HCOONa при пропускании угарного газа через расплавленную щелочь можно получить формиат – соль муравьиной кислоты. В связи с этим угарный газ формально может быть отнесен к кислотным оксидам HCOONa при пропускании угарного газа через расплавленную щелочь можно получить формиат – соль муравьиной кислоты. В связи с этим угарный газ формально может быть отнесен к кислотным оксидам
| CO2 + 2NaOH (изб) →Na2CO3 + H2O CO2 + NaOH (недост) →NaHCO3 |
| Na2O2 + CO → Na2CO3 (нагревание) | 2Na2O2 + 2CO2 → Na2CO3 + O2 (реакция идет при комнатной температуре) |
| Качественная реакция | |
| PdCl2 + CO + H2O →Pd + CO2 + 2HCl – при пропускании угарного газа через раствор соли палладия выпадает серый осадок | CO2 + Ca(OH)2 →CaCO3 + H2O CаCO3 + CO2 + H2O→Ca(HCO3)2 – при пропускании углекислого газа через известковую воду сначала выпадает осадок, который постепенно растворяется при длительном пропускании газа |
| Монооксид углерода называют угарным газом, т.к. он образует устойчивый комплекс с атомами железа гемоглобина, что препятствует переносу кислорода к клеткам – в результате происходит отравление угарным газом. Наиболее часто можно было встретить отравление угарным газом в сельской местности. Когда топили печи и была неправильно отрегулирована подача кислорода (кислород – в недостатке) и плохо вытягивался газ на улицу (т.е. газы поступают в помещение), то образовывался монооксид углерода в большом количестве и поступал в жилые помещения. Т.к. газ без вкуса и без запаха, бесцветный, то человек не замечал поступление газа, а чувствовал только упадок сил (как раз из-за уменьшения количества кислорода). В городе мы можем столкнуться с такой проблемой, если машина с работающим двигателем долго стоит в гараже, т.е. в замкнутом пространстве. | Диоксид углерода – является кислотным оксидом, ему соответствует угольная кислота H2CO3. Угольная кислота – слабая; т.о. соли угольной кислоты подвержены гидролизу по аниону. Соли угольной кислоты – карбонаты; растворимыми являются только карбонаты щелочных металлов и аммония, для остальных катионов – или соли плохо растворимы или не существуют. |
Угольная кислота.
В молекуле H2CO3 при одном атоме углерода находятся три кислорода, этим объясняется неустойчивость угольной кислоты: H2CO3«СO2 + H2O. В свободном состоянии это вещество не выделено. Угольная кислота является слабым электролитом, диссоциирует ступенчато: H2CO3 «H+ + HCO3– HCO3-«H++CO32- Угольная кислота образует два вида солей – кислые (гидрокарбонаты) и средние (карбонаты). В воде растворимы карбонаты щелочных металлов и аммония, гидрокарбонаты растворимы все. Легко осуществляется переход из кислых солей в средние и обратно: Na2CO3 + CO2 + H2O →2NaHCO3 2NaHCO3 → Na2CO3 + CO2 + H2O (нагревание). Нерастворимые карбонаты при нагревании разлагаются CaCO3 →CaO + CO2 Карбонаты натрия и калия не разлагаются. Гидрокарбонаты разлагаются все: Ca(HCO3)2→CaCO3 + CO2 + H2O Растворимые карбонаты подвергаются гидролизу по аниону: CO32- + H2O «HCO3- + OH-, гидрокарбонаты также гидролизуются, реакция среды щелочная: HCO3- + H2O «H2CO3 + OH-. Соли угольной кислоты имеют тривиальные названия (рекомендуем их запомнить): NaHCO3 питьевая сода, Na2CO3 – кальцинированная сода, Na2CO3∙10H2O – кристаллическая сода.
Применение С и его соединений:
1) С – а) для получения искусственных алмазов б) в медицине – активированный уголь (карболен) используется для адсорбции токсинов в) для изготовления крема для обуви, черной краски г) для получения сахара д) для получения CaC2 е) для получения фосфора, чугуна, стали
2) СO – а) газообразное топливо б) в реакциях органического синтеза
3) СO2 – а) для тушения пожаров. б) при изготовлении лимонадов, в) для получения «сухого льда», г) для получения моющих средств, д) для получения лекарств
|
Дата добавления: 2014-01-20; Просмотров: 1443; Нарушение авторских прав?; Мы поможем в написании вашей работы!