
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз
|
|
|
|
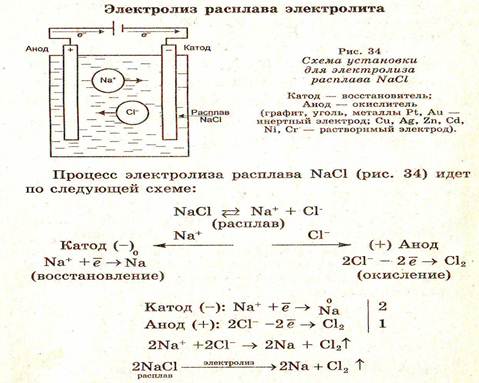
Электролиз – это процесс разложения расплавов и растворов электролитов под действием электрического тока.
В раствор или расплав какого-либо электролита опускают электроды: катод (-) и анод (+).
При электролизе на катоде могут происходить восстановление (Э+n + пe = Э°, где Э — элемент), а на аноде — окисление (Эn- - пe = Э°). При этом ионы, образовавшиеся при диссоциации электролита, движутся к электродам и разряжаются на них, принимая или отдавая электроны.
Различают электролиз расплавов и растворов электролитов.

Если катодное и анодное пространство не разделены перегородкой, то ионы Н+ и ОН образуют воду и тогда уравнение имеет вид:  .Таким образом электролиз водного раствора сульфата натрия сводится к электролизу воды, при этом растворенная соль остается неизменной.
.Таким образом электролиз водного раствора сульфата натрия сводится к электролизу воды, при этом растворенная соль остается неизменной.




Суммируя, можно сказать, что в процессе электролиза раствора электролита на электродах всегда могут происходить следующие процессы:
1) На аноде
— окисление аниона, входящего в состав электролита;
— окисление гидроксид-ионов из воды до кислорода;
— растворение материала анода (если он не инертный)
2) На катоде
— восстановление катиона, входящего в состав электролита;
— восстановление катионов водорода из воды до водорода.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1045; Нарушение авторских прав?; Мы поможем в написании вашей работы!