
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сравнительная характеристика галогенводородов
|
|
|
|
Таблица 2
| Свойство | НF | НCl | НBr | НI |
| Длина связи, пм | 127,5 | 141,5 | ||
| Энергия связи, кДж/моль | ||||
| Дипольный момент, D | 1,86 | 1,11 | 0,79 | 0,38 |
| Температура плавления, ºС | –83,5 | –114,2 | –86,9 | –51 |
| Температура кипения, ºС | 19,5 | –85,1 | –67,1 | –35,1 |
Стандартная энтальпия образования 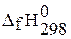 , кДж/моль , кДж/моль
| –271 | –92 | –36 | |
Стандартная энергия образования 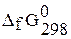 , кДж/моль , кДж/моль
| –272,8 | –94,8 | –53,2 | +1,78 |
| Кд | 6 × 10–4 | 1 × 107 | 1 × 109 | 2 × 1011 |
В стандартных условиях галогеноводороды – бесцветные газы с резким запахом.
В VII группе главной подгруппе сверху вниз орбитальный радиус галогенов увеличивается, поэтому длина связи Н – X возрастает, а энергия связи Н – X уменьшается.
Дипольные моменты убывают в ряду HF – НCl – НBr – НI. Полярность молекул, которая количественно характеризуется величиной дипольного момента, также уменьшается.
В ряду галогеноводородов от НCl к НI температуры плавления и кипения возрастают. Для веществ с молекулярной кристаллической решеткой температуры плавления и кипения зависят от величины энергии межмолекулярного взаимодействия. Полярность молекул галогеноводородов в данном ряду уменьшается, поэтому увеличение температур кипения и плавления от НCl к НI нельзя объяснить изменением полярности. Это возрастание объясняется увеличением поляризуемости вследствие увеличения длины химической связи и общего числа электронов. Закономерность изменения температур кипения и плавления в ряду галогеноводородов нарушается для фтороводорода, имеющего высокие температуры кипения и плавления. Это объясняется усилением межмолекулярного взаимодействия за счет образования водородных связей между молекулами HF. Для НCl, НBr, НI образование водородных связей не характерно из-за меньшей электроотрицательности атома галогена.
|
|
|
Стандартные энтальпии образования в ряду HF – НCl – НBr – НI увеличиваются, что объясняется уменьшением энергии связи. HF, НCl, НBr в стандартных условиях образуются из простых веществ с выделением теплоты (экзотермический процесс). HI в стандартных условиях образуются из простых веществ с поглощением теплоты.
Термическая устойчивость в ряду HF – НCl – НBr – НI уменьшается, что объясняется увеличением длины связи и уменьшением прочности связи Н – Х. HF и НCl очень устойчивы, НBr устойчив при обычной температуре, HI не устойчив.
Газообразные галогеноводороды хорошо растворимы в воде (по причине высокой полярности связи Н – Х). Например, один объем воды при 0 ºС растворяет 507 объемов HCl и 612 объемов HBr.
В водных растворах молекулы галогеноводородов диссоциируют с образованием иона гидроксония Н3О+ и галогенид-иона:
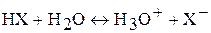 (
( )
)
то есть их водные растворы являются кислотами.
С водой HF, НCl, НBr, НI образуют азеотропные смеси, которые при постоянном давлении кипят без изменения состава и температуры.
Таблица 3
| Свойство | НF | НCl | НBr | НI |
| Температура кипения, ºС (при р = 1 атм) | ||||
| Концентрация НХ, мас.% | –271 | –92 | –36 |
В ряду HF – НCl – НBr – НI сила кислот увеличивается, что в основном объясняется уменьшением в этом ряду прочности связи Н – Х (Þ увеличение способности к диссоциации). Особо прочная связь в молекуле HF, потому фтороводородная кислота слабее других галогеноводородных кислот. Таким образом, водные растворы НCl, НBr, НI – сильные кислоты, а разбавленный водный раствор HF является слабой кислотой (кислотой средней силы).
Прим. При повышении концентрации HF выше 1 моль/л сила кислот увеличивается вследствие образования гидрофторид иона  за счет водородной связи.
за счет водородной связи.
Галогеноводороды – восстановители (за счет галогенид иона). В ряду HF – НCl – НBr – НI энергия ионизации атома галогена уменьшается, восстановительная способность увеличивается.
|
|
|
Таблица 4
| F | Cl | Br | I | |
Стандартный электродный потенциал  , В , В
| +2,82 | +1,36 | +1,06 | +0,53 |
Например, плавиковая и соляная кислоты с концентрированной серной кислотой не взаимодействуют, а НBr и НI ее окисляют:

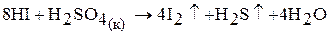
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 6897; Нарушение авторских прав?; Мы поможем в написании вашей работы!