
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Структура электронных оболочек атомов
|
|
|
|
Общие сведения о строении вещества
Электрофизические свойства радиоматериалов
Материалы, применяемые в электронной технике, подразделяют на радиоматериалы и конструкционные материалы.
Под радиоматериалами понимают материалы, свойства которых зависят от электрических и магнитных полей.
Конструкционными материалами называют материалы, которые должны обеспечивать механическую прочность изделий, создаваемых из этих материалов. Электрические и механические свойства материалов обусловлены их структурой, которая, в свою очередь, определяется структурой электронных оболочек атомов.
По реакции на электрическое поле радиоматериалы делят на проводники, диэлектрики и полупроводники.
По реакции на магнитное поле различают магнитные и немагнитные материалы.
Все вещества состоят из атомов. Из атомов состоят молекулы. Из молекул состоит вещество. Вещество может находиться в газообразном, жидком или твердом состоянии. Эти истины знает каждый школьник. Для того чтобы разобраться в том, как устроены и работают современные сложные электронные приборы, необходимо систематизировать некоторые основные положения физики, начиная со структуры атомов и молекул.
Современная физика рассматривает атомы как частицы, состоящие из положительно заряженных ядер, окруженных электронными оболочками. Электроны относятся к категории микрочастиц, которым присущ принцип дуализма, то есть они обладают как свойствами частицы, так и свойствами волны. Ни видеть, ни осязать электроны нельзя. Поэтому, изучая их, приходится пользоваться моделями и абстракциями.
Простейшей, наиболее наглядной моделью, является модель Н. Бора, в которой электроны уподобляются шарикам, вращающимся вокруг ядра по определенным орбитам. С точки зрения квантовой физики такое представление ошибочно, так как микрочастица не может одновременно обладать определенными значениями координаты и импульса. Поэтому применительно к микрочастице понятие траектории теряет смысл. Квантовая механика в состоянии предсказать лишь вероятность нахождения электрона в данной точке пространства. Эта вероятность представляет собой «усредненную» картину поведения электрона, что позволяет представить электрон в виде облака, которое называют орбиталью.
|
|
|
Если в атоме водорода, удаляясь от ядра, проследить вероятность нахождения электрона, то окажется, что у самого ядра она равна нулю, потом возрастает, достигая максимального значения на расстоянии 0,53*10-8 см от ядра, а затем постепенно убывает. Расстояние r = 0,53*10-8 см условно принимают за радиус орбиты в атоме водорода, а сам электрон рассматривают в виде шарика массой m = 9,1*10-31 кг и зарядом q = 1,6*10-19 Кл. Количество вращающихся вокруг ядра электронов определяется порядковым номером химического элемента в периодической системе Д. И. Менделеева: в атоме водорода — один электрон, в атоме гелия — два и т. д.
Движение электронов вокруг ядра происходит по строго определенным орбитам так, что на длине орбиты укладывается целое число длин волн, называемых волнами Де Бройля. При этом условии на длине орбиты образуется стоячая волна и не происходит излучения электромагнитной энергии. В противном случае электрон будет терять свою энергию, радиус орбиты станет уменьшаться и в результате электрон окажется притянутым к ядру.
Волны де Бройля – это волны любой микрочастицы, отражающие их квантовую структуру, т. е. возможность частицы переносить энергию.
В начальном (невозбужденном) состоянии электрон в атоме водорода находится на наиболее близкой к ядру орбите и обладает энергией Е = -13,6 эВ. Путем внешнего энергетического воздействия он может быть переведен на более удаленную орбиту. Такое состояние атома называется возбужденным, оно является неустойчивым. В любом атоме электроны стремятся занять наиболее низкие энергетические уровни, поэтому спустя некоторое время электрон вернется на первоначальную орбиту, выделив при этом квант энергии, равный разности соответствующих энергетических уровней.
|
|
|
В многоэлектронных атомах потенциальная энергия электрона зависит не только от его расстояния до ядра, но и от расстояний до каждого из остальных электронов, вследствие чего численные значения радиусов орбит и, соответственно, величины энергии не совпадают с численными значениями радиусов и энергии для атома водорода. Вращение электронов в этих атомах может происходить как по круговым, так и по эллиптическим орбитам. Движение электрона по круговой орбите соответствует сферическому электронному облаку, а движение по эллиптической орбите — облаку в форме гантели. При этом электроны стремятся занять наиболее низкие энергетические уровни, но при условии, что на каждом энергетическом уровне находится не более двух электронов (принцип Паули). Чем больше электронов в атоме, тем более высокие энергетические уровни они занимают. Возможные энергетические состояния электронов характеризуют четырьмя квантовыми числами.
Главное квантовое число п определяет радиус круговой орбиты или большую полуось эллиптической. Оно может принимать значение п = 1, 2, 3 и т. д. Чем больше и, тем больше радиус орбиты и энергия электрона. Состояния электрона, определяемые главным квантовым числом, называют энергетическими уровнями.
Орбитальное квантовое число l определяет малую полуось эллиптической орбиты. Оно может принимать значения l = 0,1,2,…(n-1). Значение 1=0 соответствует круговой орбите. Энергетические состояния, характеризующиеся различными значениями l, называют подуровнями. Значению l = 0 соответствует s-подуровень, значению l=1 — р-подуровень, значению l = 2 — d-подуровень, значению l = 3 — f-подуровень.
Магнитное квантовое число т определяет пространственную ориентацию эллиптической орбиты. Оно может принимать значения т = 0, ±1, ±2,…± l. Каждому квантовому числу l соответствует (2 l + 1) по-разному ориентированных орбит. При l = 1 возможны три взаимно-перпендикулярных р-орбиты; орбитальному квантовому числу l = 2 соответствует пять возможных пространственных ориентации орбит, называемых d-орбитами; квантовому числу l = 3 соответствует семь f-орбит.
|
|
|
Спиновое квантовое число s определяет момент количества движения электрона вокруг собственной оси. Вектор момента количества движения может быть параллелен или антипараллелен вектору орбитального момента. Спин электрона равен половине постоянной Планка, поэтому он равен +0,5 или -0,5.
Определим число возможных энергетических состояний на любом из энергетических уровней. На первом энергетическом уровне (n = 1) могут разместиться два электрона с противоположными спинами, что можно записать в виде 1s2, где 1 — номер энергетического уровня, s — состояние электрона на этом уровне, 2 - количество электронов в данном состоянии. На втором энергетическом уровне (n = 2) в s-состоянии могут находиться два электрона (2s2), в р-состоянии — шесть электронов (2р6). На третьем энергетическом уровне (п = 3) в s-состоянии могут находиться два электрона (3s2), в р-состоянии — шесть электронов (Зр6), в d-состоянии — десять электронов (3d10) и т. д.
При рассмотрении структуры электронных оболочек конкретных атомов следует руководствоваться двумя принципами:
1) в атоме не может быть двух электронов с одинаковой комбинацией квантовых чисел;
2) в нормальном (невозбужденном) состоянии электроны занимают квантовые состояния с наименьшей энергией.
Проследим, как заполняются электронные оболочки атомов по мере роста порядкового номера химического элемента в периодической таблице Д. И. Менделеева. В атоме водорода имеется один электрон на орбите 1s с произвольной ориентацией спина. Его энергетическое состояние может быть записано так: 1s1. В атоме гелия имеется два электрона с противоположными спинами. Его энергетическое состояние может быть записано так: 1s2. В атоме лития первая оболочка полностью заполнена электронами, поэтому третий электрон располагается на уровне 2s, в результате получается электронная конфигурация 1s22s1. У бериллия структура оболочки имеет вид ls22s2. У бора пятый электрон занимает состояние 2р, и структура принимает вид ls22s22p1. У последующих элементов происходит дальнейшее заполнение состояния 2р. У неона все возможные состояния 2р полностью заняты, и структура принимает вид ls22s22p6. Аналогичным образом происходит заполнение электронных оболочек третьего периода периодической таблицы. Структура оболочек аргона, завершающего этот период, имеет вид ls22s22p63s23p6. После заполнения уровня Зр6 электроны сначала заполняют состояние 4s, так как энергетический подуровень 4s расположен ниже подуровня 3d, а затем состояния 3d и 4р. Правило заполнения оболочек можно записать в таком виде:
|
|
|
ls22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2.
Атомы элементов каждой группы периодической таблицы имеют одинаковое строение внешних и достраивающихся подуровней. Это наглядно видно на примере элементов четвертой группы:
□ углерод (С) - ls22s22p2;
□ кремний (Si) - ls22s22p63s23p2;
□ германий (Ge) - ls22s22p63s23p63d104s24p2.
Периодическая повторяемость структуры внешних электронных оболочек обусловливает периодическую повторяемость химических свойств элементов. Так, например, кремний и германий качественно обладают одинаковыми свойствами, различие состоит лишь в количественной оценке этих свойств.
2. Основные понятия зонной теории
В изолированном атоме электроны способны занимать лишь дискретные энергетические уровни, определяемые силами притяжения к ядру и силами отталкивания от других электронов. В твердом теле атомы расположены настолько близко друг к другу, что между ними возникают новые силы взаимодействия — это силы отталкивания между ядрами и между электронами соседних атомов и силы притяжения между всеми ядрами и всеми электронами. Под действием этих сил энергетические состояния в атомах изменяются: энергия одних электронов увеличивается, других — уменьшается. В результате вместо дискретных уровней изолированного атома образуются энергетические зоны, состоящие из очень близко расположенных энергетических уровней, плотность которых возрастает по мере удаления от краев зоны по параболическому закону, достигая максимума в середине зоны.
Механизм образования энергетических зон схематически показан на рис. 1.1. По мере сближения атомов (уменьшения расстояний) сначала расщепляются самые высокие энергетические уровни, затем по мере сближения атомов — более низкие.

Рис. 1.1
При сближении атомов на расстояние а0 образуется устойчивая кристаллическая структура, которой соответствует энергетическая диаграмма, показанная в левой части рисунка. Разрешенные зоны отделены друг от друга запрещенными зонами, в которых отсутствуют разрешенные уровни. Ширина разрешенных зон по мере перемещения вверх по энергетической шкале возрастает, а ширина запрещенных зон соответственно уменьшается. Во многих случаях может иметь место перекрытие разрешенных энергетических зон. Подобно энергетическим уровням в изолированных атомах энергетические зоны могут быть полностью заполненными электронами, частично заполненными и свободными. Все зависит от структуры электронных оболочек изолированных атомов и межатомных расстояний в кристалле. Внутренние оболочки изолированных атомов полностью заполнены электронами, поэтому соответствующие им зоны также оказываются заполненными.
Самую верхнюю из зон, частично или полностью заполненную электронами, называют валентной зоной, а ближайшую к ней незаполненную электронами — зоной проводимости (выше валентной зоны). Взаимное положение этих зон зависит от структуры оболочек изолированных атомов и определяет большинство процессов в твердом теле.
С точки зрения зонной теории все твердые тела можно подразделить на две основные группы: материалы, у которых валентная зона перекрывается зоной проводимости, и материалы, у которых валентная зона и зона проводимости разделены запрещенной зоной.
В первом случае незначительное внешнее энергетическое воздействие переводит электроны на более высокие энергетические уровни, что обусловливает хорошую электропроводность материалов. Во втором случае переходы на более высокие энергетические уровни связаны с необходимостью внешнего энергетического воздействия, превышающего ширину запрещенной зоны. Материалы, в энергетической диаграмме которых отсутствует запрещенная зона, относятся к категории проводников, материалы с узкой запрещенной зоной (менее 3 эВ) — к категории полупроводников и материалы с широкой запрещенной зоной (более 3 эВ) — к категории диэлектриков.
3. Собственные и примесные полупроводники
1. Собственными полупроводниками, или полупроводниками типа i (от англ. intrinsic — собственный), называют полупроводники, кристаллическая решетка которых в идеальном случае не содержит примесных атомов другой валентности.
В реальных условиях в кристаллической решетке полупроводника всегда существуют примеси, однако их концентрация столь ничтожна, что ею можно пренебречь. Атомы в кристаллической решетке полупроводника расположены упорядоченно на таких расстояниях друг от друга, что их внешние электронные оболочки перекрываются, и у электронов соседних атомов появляются общие орбиты, посредством которых образуются ковалентные связи. Если валентность атомов равна четырем, то вокруг каждого из атомов, помимо четырех собственных, вращаются еще четыре «чужих» электрона, вследствие чего вокруг атомов образуются прочные электронные оболочки, состоящие из восьми обобществленных валентных электронов, что иллюстрирует плоская модель кристаллической решетки, показанная на рис. 1.2.
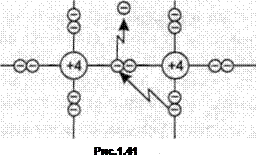
В узлах кристаллической решетки арсенида галлия чередуются пятивалентные атомы мышьяка и трехвалентные атомы галлия, вокруг которых также образуются электронные оболочки из восьми обобществленных электронов.
При сообщении кристаллической решетке некоторого дополнительного количества энергии, например путем нагрева, электрон может покинуть ковалентную связь и превратиться в свободный носитель электрического заряда. В результате ковалентная связь становится дефектной, в ней образуется «вакантное» место, которое может занять один из валентных электронов соседней связи. При этом вакантное место перемещается к другому атому. Перемещение вакантного места внутри кристаллической решетки принято рассматривать как перемещение некоторого положительного заряда, называемого дыркой. Величина этого заряда равна заряду электрона.
Тепловая генерация – это процесс образования свободных электронов и дырок под воздействием тепла. Она характеризуется скоростью генерации G, определяющей количество пар носителей заряда, генерируемых в единицу времени. Помимо тепловой генерации возможна генерация под воздействием света или каких-либо других энергетических воздействий. Возникшие в результате генерации носители заряда находятся в состоянии хаотического движения, средняя тепловая скорость которого определяется формулой
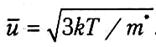
K=0,86*10-4 эВ/градус - постоянная Больцмана;
Т – абсолютная температура;
m – эффективная масса электрона, учитывающая взаимодействие электрона с периодическим полем кристаллической решетки, то есть это масса свободного электрона, который под действием внешней силы смог бы приобрести такое же ускорение, как электрон в кристалле под действием той же силы.
Двигаясь хаотически, электроны могут занимать вакантные места в ковалентных связях. Это явление называют рекомбинацией и характеризуют скоростью рекомбинации R, определяющей количество пар носителей заряда, исчезающих в единицу времени. Каждый из подвижных носителей заряда существует («живет») в течение некоторого промежутка времени, среднее значение которого называют временем жизни носителей заряда и обозначают для электронов  , а для дырок
, а для дырок  . В собственном полупроводнике
. В собственном полупроводнике  .
.
В равновесном состоянии генерация и рекомбинация протекают с одинаковой скоростью (R = G), поэтому в полупроводнике устанавливается собственная концентрация электронов, обозначаемая  и собственная концентрация дырок, обозначаемая
и собственная концентрация дырок, обозначаемая  . Поскольку электроны и дырки генерируются попарно, то в собственном полупроводнике выполняется условие
. Поскольку электроны и дырки генерируются попарно, то в собственном полупроводнике выполняется условие
 .
.
При комнатной температуре в кремнии
 ,
,
а в германии

С увеличением температуры собственные концентрации электронов и дырок растут по экспоненциальному закону.
2. Примесные полупроводники – это полупроводники, кристаллическая решетка которых помимо четырехвалентных атомов содержит атомы с валентностью, отличающейся от валентности основных атомов, и их концентрация превышает собственную концентрацию носителей заряда.
Если валентность примесных атомов больше валентности основных атомов (в кристаллическую решетку кремния введены пятивалентные атомы мышьяка), то пятый валентный электрон примесного атома оказывается незанятым в ковалентной связи, то есть становится лишним (рис. 3) и легко отрывается от атома, становясь свободным. При этом примесный атом оказывается ионизированным и приобретает положительный заряд. Такой полупроводник называют электронным, или полупроводником типа п (от лат. negative — отрицательный), а примесные атомы называют донорами.
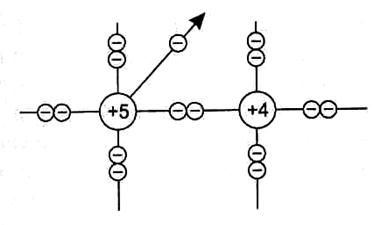
Рис. 3
Если в кристаллическую решетку кремния введены атомы трехвалентной примеси (например атомы алюминия), то одна из ковалентных связей оказывается незаполненной (рис. 4). При незначительном тепловом воздействии электрон одной из соседних связей может перейти в незаполненную связь, а на том месте, откуда пришел электрон, возникает дырка. При этом примесный атом приобретает отрицательный заряд. Такой полупроводник называют дырочным, или полупроводником типа р (от лат. positive — положительный), а примесные атомы называют акцепторами.

Рис. 4
С точки зрения зонной теории, при тепловой генерации происходит переход электронов из валентной зоны в зону проводимости, а при рекомбинации — их возврат из зоны проводимости в валентную зону (рис. 5).

Рис. 5
Скорость тепловой генерации обратно пропорциональна ширине запрещенной зоны и прямо пропорциональна температуре Т.

При Т = 300 К значение ширины запрещенной зоны составляет:
-для германия 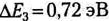 ;
;
-для кремния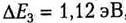 ;
;
-для арсенида галлия  .
.
Чем шире запрещенная зона, тем меньше концентрация собственных носителей заряда.
В электронном полупроводнике из-за наличия пятивалентных примесных атомов в пределах запрещенной зоны вблизи дна зоны проводимости появляются примесные уровни  (рис. 6).
(рис. 6).

Рис. 6
Поскольку на один примесный атом приходится примерно 106-108 атомов основного вещества и расстояние между ними большое, то они практически не взаимодействуют друг с другом. Поэтому примесные уровни не расщепляются, и их изображают как один локальный уровень, на котором находятся «лишние» валентные электроны, не занятые в ковалентных связях.
Энергетический интервал 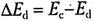 называют энергией ионизации доноров (для кремния
называют энергией ионизации доноров (для кремния 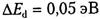 , для германия
, для германия 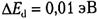 ). Электроны, находящиеся на уровне
). Электроны, находящиеся на уровне  , переходят с уровня
, переходят с уровня  в зону проводимости. При комнатной температуре практически все доноры ионизированы, поэтому концентрация электронов примерно равна концентрации доноров
в зону проводимости. При комнатной температуре практически все доноры ионизированы, поэтому концентрация электронов примерно равна концентрации доноров  .
.
Наряду с ионизацией примеси в электронном полупроводнике происходит тепловая генерация, но количество образующихся при этом электронов и дырок существенно меньше, чем в собственном полупроводнике. Объясняется это тем, что электроны, полученные в результате ионизации донорных атомов, занимают нижние энергетические уровни зоны проводимости и переход электронов из валентной зоны может происходить только на более высокие уровни зоны проводимости. Но для таких переходов электроны должны обладать более высокой энергией, чем в собственном полупроводнике, и поэтому значительно меньшее число электронов способно их осуществить. Поэтому в электронном полупроводнике концентрация дырок  меньше концентрации
меньше концентрации  .
.
Электроны в электронном полупроводнике называют основными носителями заряда, а дырки — неосновными.
В дырочном полупроводнике за счет введения трехвалентных примесных атомов в пределах запрещенной зоны появляется примесный уровень Еа (рис. 7), который заполняется электронами, переходящими на него из валентной зоны.
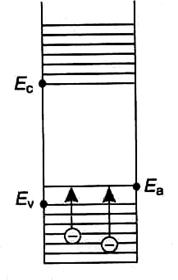
Рис. 7
Поэтому в полупроводнике устанавливается высокая концентрация дырок рр. При комнатной температуре практически все акцепторы ионизированы, поэтому концентрация дырок примерно равна концентрации акцепторов (рр = Na).
В дырочном полупроводнике так же, как и в электронном, происходит тепловая генерация, однако количество образующихся при этом пар носителей заряда невелико. Объясняется это теми же причинами, что и для электронного полупроводника. На уровни акцепторов переходят электроны с энергетических уровней, расположенных вблизи потолка валентной зоны, а переход электронов из валентной зоны в зону проводимости совершают электроны, расположенные на более низких уровнях валентной зоны, для чего необходимо затратить более высокую энергию, чем в собственном полупроводнике. Поэтому концентрация электронов пр меньше концентрации пi.
Дырки в дырочном полупроводнике называют основными носителями заряда, а электроны — неосновными.
Неравновесное состояние полупроводника
Неравновесное состояние полупроводника возникает под влиянием каких-либо внешних воздействий, в результате которых концентрация носителей заряда в полупроводнике может измениться. Такими внешними воздействиями могут быть облучение светом, ионизирующее облучение, воздействие сильного электрического поля, приводящее к разрыву ковалентных связей, и ряд других.
В результате подобных воздействий в полупроводнике помимо равновесных носителей заряда, образующихся вследствие ионизации примесных атомов и тепловой генерации, появляются дополнительные носители заряда, которые называют неравновесными, или избыточными. В полупроводниковых приборах неравновесное состояние в большинстве случаев возникает при введении в полупроводник (или выведении из него) дополнительных носителей заряда через электронно-дырочный переход. Введение через электронно-дырочный переход дополнительных носителей заряда называют инжекцией, а выведение — экстракцией.
ТЕМА 2. ЭЛЕКТРОННО-ДЫРОЧНЫЙ ПЕРЕХОД.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1336; Нарушение авторских прав?; Мы поможем в написании вашей работы!