
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые титрования
|
|
|
|
3.
2.
1.Влияние одноименных ионов снижает растворимость осадка (Ks. – остается постоянной)
2. Присутствие разноименных ионов увеличивает растворимость осадка (солевой эффект), это связано с изменением ионной силы раствора μ:
Ks = aAg+aCL- = fAg+CAg+ fCL-CCL-;
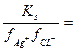 CAg+ CCL-;
CAg+ CCL-;
μ = ½ ΣCi Zi2
-lgf = 0,5 Z2 
- lgf = 0,5 Z2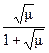
введение электролита μ↑ приводит к ↓f (-lgf) f↓ следовательно С↑.
3. Влияние рН
При осаждении гидроксидов величина рН определяется величиной Ks, чем Ks меньше, тем при меньшем значении рН производится осаждение
Fe(OH)3 Ks=10-38 рН = 3,5
Ni(OH)2 10-15 рН = 9,8
Mg(OH)2 10-10 рН = 12,4
Кислоты (H2SiO3) осаждают из кислых растворов (рН 1-2)
Соли – определяются природой аниона
BaSO4 не имеет значение рН (осадок нерастворим в кислотах и щелочах)
BaCrO4 при рН 4 – 5
ВаСО3 рН>8.
4. Температура с увеличением температуры растворимость увеличивается.
Растворимость осадков, стр.88, Васильев.
По применяемому титранту:
- аргентометрия – титрант AgNO3
- роданометрия – титрант KSC N, NH4SCN (тиоцианатометрия)
N, NH4SCN (тиоцианатометрия)
- меркурометрия титрант – соли Н.g22+ (Hg2(NO3)
По способу фиксирования точки стехиометричности
- без индикатора (равного помутнения, Гей-Люссак до точки просветвления)
- титрование с индикатором (Мора, Фольгарда, Фаянса)
4. Метод Мора – определяют Cl-, Br-
рН≥7
титрант AgNO3; станд. NaCL
индикатор K2CrO4
Титрование ведут до начала выпадения (от одной капли титранта) красного осадка AgCrO4
Первоначально выпадает AgCL, несмотря на то, что K3(AgCL) ›K3(Ag2CrO4)
K3(AgCL) = 1,8 ∙ 10-10; K3(Ag2CrO4) = 4∙ 10-12, т.к. растворимость AgCL составляет
 ∙10-5моль/дм3
∙10-5моль/дм3
растворимость  Ag2CrO4 (2S)2 = 4∙10-12
Ag2CrO4 (2S)2 = 4∙10-12
S(Ag2CrO4) =  -4моль/дм3
-4моль/дм3
Титровать можно до рН ‹ 10,5, т.к. дальнейшее увеличение рН приводит к образованию Ag2O.
Метод Фаянса - индикаторы – адсорбционные индикаторы – вещества, которые изменяют свою окраску при осаждении (адсорбции) на поверхности осадка.
|
|
|
флуоресцин (CL-) до точки стехиометричности
желто-зеленый
на поверхности осадка образуется слой
отрицательно заряженных ионов CL- (они в
избытке)
Посте точки стехиометричности
красный
рН 7…..10
Можно применять эозин (Br-, I-, SCN-)
Родамин G.
Метод Фольгарда – обратное титрование в кислой среде.
CL- + Ag+изб. → AgCL↓ + Ag+ост.
Ag+ост. + SCN- → AgSCN
Индикатор NH4Fe(SO4)2
(NH4Fe(SO4)2∙12H2O) железоалюминиевые квасцы
Лишняя капля SCN- приводит к образованию красного соединения [Fe(SCN)6]3-.
до точки стехиометричности
Ag+
Cl AgCl↓
[Cl-] =
[Ag+] = 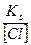 ; т.к. [Ag+]∙[Cl-]= Кs
; т.к. [Ag+]∙[Cl-]= Кs
в точке стехиометричности
[Cl-]=[Ag+]=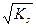
после точки стехиометричности
[Ag+]=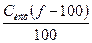
[Cl-]=
pCl = -lg[Cl-]
pAg=-lg[Ag+]
pCl pAg
f
Cкачок зависит от: значения Кs (Кs ↓ ск.↑)
С С↑, ск. ↑
степень точности титрования
6. Из всех методов наиболее применим метод Фольгарда – можно определять Br-, Cl-, J-, C2O42-, PO42-, S2-.
В неводной среде можно определять SO42- (титрант BaCl2, индикатор ализариновый красный S).
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 284; Нарушение авторских прав?; Мы поможем в написании вашей работы!