
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процессы, протекающие при погружении Ме в раствор
|
|
|
|
а) разделение зарядов на границе фаз 
случай 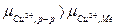 , металл заряжается положительно
, металл заряжается положительно
б) возникновение двойного электрического слоя (ДЭС)
в) абсолютный скачок потенциала (гальвани-потенциал)
(гальвани-потенциал)
Историческая справка об открытии гальванических явлений
1. Л.Гальвани(1791) – опыты с препарированной лапкой лягушки
2. А.Вольта (1800) – реализация 1 ой электрохимической цепи
а) сокращение зависит от природы замыкаемых на мышцу 
б) создание 1-го источника тока 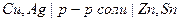
Основные понятия и определения
1. Электрод
а) понятие, условная запись, электродная реакция
1) Электродом наз. электрохим. система, состоящая, как минимум, из 2-ух проводящих фаз, одна из которых является электролитом (проводник 2-го рода), а другая может быть металлом, полупроводником или мембраной из полиэлектролитного полимерного материала (стекла, например).
2) Примеры:  или
или 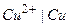 ,
, 
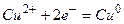

б) обратимые и необратимые электроды:
1) 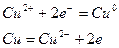 2)
2) 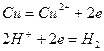
2. Обратимые гальванические элементы
а) определение – устройство, в котором вырабатывается элект-рическая энергия за счет протекания эл.-хим. процессов
б) пример: элемент Якоби-Даниэля
в) контакт растворов эл-литов (перегородка, солевой мостик)
г) неправильно разомкнутый г.э.,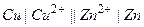
д) фазовый жидкостной (диффузионный) потенциал,  .
.
е) правильно разомкнутый г.э., 
ж) контактная разность потенциалов, 
3. Электрохимический потенциал. Гальвани-потенциал
а) 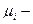 характеристика энергет. состояния незаряженной частицы
характеристика энергет. состояния незаряженной частицы
б) состояние заряженной частицы – введение понятия электро- химического потенциал (Гугенгейм, 1933),
 , где
, где 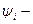 внутренний потенциал
внутренний потенциал
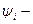 внутренний потенциал – работа по перемещению единичного положительного нематериального заряда из глубины фазы в бесконечность
внутренний потенциал – работа по перемещению единичного положительного нематериального заряда из глубины фазы в бесконечность
в) перенос заряженной материальной частицы из одной фазы  в другую
в другую 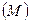 определяется:
определяется: 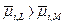 , т.е.
, т.е. 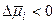
г) равновесие:  :
: 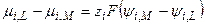
д) абсолютный электродный или гальвани-потенциал
1)  ,
, 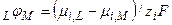
2) величины, определяющие 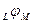 :
: 

3) Следствия полученного соотношения
а) на гр-це раздела фаз всегда возникает скачок потенциала
б) невозможность экспериментального определения 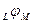
Строение ДЭС
1. плотная часть ДЭС – слой Гельмгольца (плоский конденсатор,
толщина – радиус сольватированных противоионов).
2. диффузная часть ДЭС – слой Гуи, толщина слоя определяется силами эл.-ст. взаимодействия и тепловым движением ( )
)
3. распределение потенциала в ДЭС, 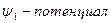 (падение в диффузной части).
(падение в диффузной части).
4. строение ДЭС и изменение потенциала в случае специфической
адсорбции ионов (одноименно и разноименно заряженных)
5. независимость потенциала данной системы от изменения строения ДЭС, 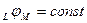 .
.
Электродвижущая сила (ЭДС) гальванического элемента
ЭДС – разность потенциалов на концах правильно разомкнутого
гальванического элемента
1. Условная схема электрохимической цепи: 
2. Запись ЭДС через гальвани-потенциалы:
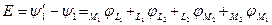 ;
;
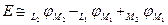 ,
,
т.к. 
3. Условный электродный потенциал, 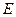
а) необходимость введения условного электродного потенц-ла
 б) стандартный водородный электрод,
б) стандартный водородный электрод,

в) определение условного электродного потенциала в водородной шкале, 
г) уравнение для условного электродного потенциала: 
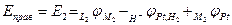 ,
,

4. Связь ЭДС гальванического элемента с потенциалами электродов
а) найдем разницу условных электродных потенциалов
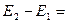
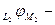


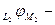
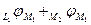
б) сопоставление с уравнением для ЭДС данного элемента
вывод 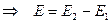
Правило знаков ЭДС элементов и электродных потенциалов
1. Основополагающее правило – ЭДС положительна, если внутри гальванического элемента положительное электри-чество (катионы) перемещается слева направо (Стокгольм, международная конференция 1953г.)
2. Выводы. При разряде ионов на правом электроде - процесс восстановления (электрод заряжается положительно), а сам электрод – положительный полюс г.э. (катод); на левом электроде – процесс окисления (отрицательный полюс, анод).
3. Соответствие знака ЭДС системе знаков теории хим. сродства а) 

б) 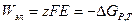 и
и  , самопроизвольный процесс
, самопроизвольный процесс
Термодинам. уравнение, связывающее ЭДС с активностями участников реакции, протекающей в г. элементе
1. Вывод уравнения: основан на теории хим. сродства: 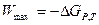
а) 
б) 
2.  , где
, где  при
при 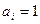 .
.
3. Пример – элемент Якоби-Даниэля: 
а) реакция:  ,
,  ;
; 
б) 

 , т.к.
, т.к. 
4. Разбавленные растворы, 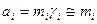 ,:
,:
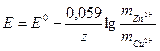 - уравнение Нернста (1890)
- уравнение Нернста (1890)
Классификация электродов
Электроды I и II рода, газовые, Ox-Red эл-ды, мембранные
Электроды 1го рода
1. Понятие, условная запись и электродный процесс
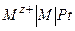 ,
, 
2. Вывод уравнения Нернста
а) условная схема электрохимич. цепи и химическая реакция

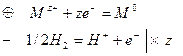

б) 

2. Примеры: 
а)  ,
, 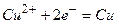 ,
, 
б) амальгамный электрод,  :
: 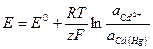
4. Неметалл/раствор, 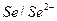 :
:  ,
, 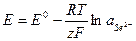
Электроды 2го рода
1. Понятие, условная запись и потенциалопределяющая реакция на электроде 2 го рода: 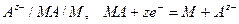
2. Вывод уравнения Нернста
а) условная схема электрохимич. цепи и химическая реакция




б) 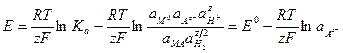
3. Примеры
а) 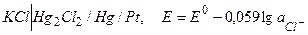 ,
, 
б) 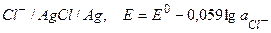 ,
, 
в) ртутнооксидный эл-д:  ,
,
 ,
, 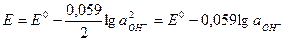
4. Электроды 2го рода – как электроды сравнения
а) недостатки водородного электрода
1) неудобен и опасен в эксплуатации (баллон с газообраз-ным водородом, сложность поддержания постоянства давления 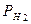 , взрывоопасен)
, взрывоопасен)
2) чувствительность потенциала электрода к загрязнениям и микропримесям в растворе (отравление  )
)
б) достоинства электродов 2-го рода
1) устойчивое и воспроизводимое от электрода к электроду значение потенциала
2) простота в изготовлении и эксплуатации
в) 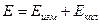 [(насыщ., 0,1н, 1н) каломельный, хлорсеребр.)
[(насыщ., 0,1н, 1н) каломельный, хлорсеребр.)
Газовые электроды
1. Понятие, устройство и функция электрода-катализатора
Газовые электроды состоят из металлического проводника, который одновременно контактирует и с газом, пропускаемым через раствор электролита, и с самим раствором, содержащим ионы, природа которых соответствует продуктам окисления или восстановления этого газа на электроде. Металлический проводник, обычно, платиновая проволока, покрытая осадком платиновой черни, сам в электродной реакции участия не принимает, а выполняет лишь функцию инертного проводника и катализирует процесс установления адсорбционного равновесия.
2. Примеры
а) водородный электрод, 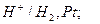
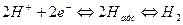
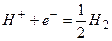 ,
, 

б) кислородный электрод: 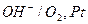 ;
;
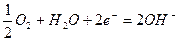
 ,
, 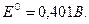
Окислительно-восстановительные электроды
1. Понятие, функция электрода, электродная реакция
Название окислительно-восстановительных электродов или 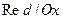 -электродов закрепилось за группой электродов, которые представляют собой инертный проводящий материал
-электродов закрепилось за группой электродов, которые представляют собой инертный проводящий материал 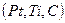 , погруженный в раствор, содержащий и окисленную, и восстановленную формы одного и того же элемента.
, погруженный в раствор, содержащий и окисленную, и восстановленную формы одного и того же элемента.

2. Примеры 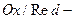 электродов, потенциал которых
электродов, потенциал которых 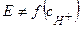 :
:
а) ферри-ферратный эл-д: 
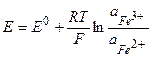
б) 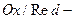 электроды, потенциал которых зависит от
электроды, потенциал которых зависит от 
хингидронный: 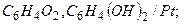

 .
.
Область работы: 0<pH<8
Основные типы гальванических элементов
1. Краткая характеристика элементов
а) по источнику электрической энергии – физические, химические и концентрационные
– в физических цепях источником эл. энергии служит различие в физическом состоянии электродов (аллотропические, гравита-ционные, термогальванические)
– в химических гальванических элементах источником эл. энергии служит химическая энергия реакции, протекающей в элементе
– концентрационными наз. элементы, в которых оба электрода одинаковы по своей природе, но различаются активностями одного или нескольких веществ - участников электродной реакции. Электрическая энергия в них получается за счет разности концентраций электрохимически активных веществ в двух одинаковых по химической природе электродах
б) по наличию границы жидких фаз (без и с переносом)
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1611; Нарушение авторских прав?; Мы поможем в написании вашей работы!