
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия. Адсорбент – фаза, определяющая форму поверхности, она более плотная, может быть твердой или жидкой
Адсорбент – фаза, определяющая форму поверхности, она более плотная, может быть твердой или жидкой.
Адсорбат – вещество, которое перераспределяется (газ или жидкость).
Десорбция - переход вещества из поверхностного слоя в объемную фазу.
Для количественного описания адсорбции применяют две величины. Одна измеряется массой адсорбента, то есть числом молей или граммов, приходящихся на единицу площади поверхности или на единицу массы адсорбента. Эту величину обозначают «А» (метод «слоя конечной толщины»). Другая характеристика величины адсорбции определяется избытком вещества в поверхностном слое по сравнению с его количеством в таком же объеме фазы также отнесенным к единице площади или единице массы адсорбента.
Эту величину называют Гиббсовской адсорбции (Г - избыток вещества в поверхностном слое по сравнению с его количеством в объемной фазе, отнесенный к единице площади поверхности или единице массы адсорбента)
 (3.1)
(3.1)
Гi -Гиббсовская адсорбция,
V -объем системы,
с0 -исходная концентрация адсорбата,
сi - концентрация адсорбата в объеме,
S - площадь поверхности раздела.
Все величины в (3.1) могут быть установлены экспериментально.
Г i может быть меньше 0, если C o < C i
Адсорбцию можно рассматривать как процесс превращения поверхностной энергии в химическую. Сложнее определить «А».
Выведем соотношение между поверхностным натяжением и химическими потенциалами компонентов системы (по методу избыточных величин).
Если объем поверхностного слоя равен 0, то
dU=T dS + s dS + å m i dn i (3.2)
Так как внутренняя энергия пропорциональна экстенсивным величинам, то =>
U=T S + s S + åm i n i. Полный дифференциал от тех же переменных запишется следующим образом:
dU=T dS + S dT + s dS +S ds + åm i dn i + å n i dm i (3.3)
Подставляя dU из 3.2 в 3.3, получим:
S dT + s ds+ å n i dm i = 0, (3.4)
при Т=const =>
sds + å n i dm i = 0 (3.5)
(3.4) и (3.5) - уравнения Гиббса для межфазной поверхности (поверхностного слоя).
Все экстенсивные величины поверхности (S, ni) зависят от площади поверхности, поэтому удобнее относить эти параметры к единице площади поверхности. Разделив уравнение (3.5) на площадь поверхности, получим:
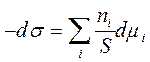 =>
=> 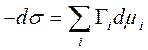 (3.6)
(3.6)
Гi - поверхностный избыток компонента i в поверхностном слое (по сравнению с его равновесной концентрацией в объемной фазе), то есть величина Гиббсовской адсорбции.
Уравнение (3.6) - фундаментальное адсорбционное уравнение Гиббса. Это строгое термодинамическое соотношение, написанное для многокомпонентной системы. Однако, практическое его использование неудобно. Оно, например, не раскрывает зависимость поверхностного натяжения от адсорбции конкретного вещества при постоянных химических потенциалах других веществ.. Единицы величины гиббсовской адсорбции определяются единицами химического потенциала. Если потенциал отнесен к молю вещества, то величина адсорбции выражается в молях на единицу площади.
Адсорбция конкретного вещества при постоянных химическихпараметрах других веществ:

Это выражение – частная производная для данного компонента.
Принимая во внимание, что m i = m i o + RT ln ai
m i и m i o - равновесное и стандартное значения химического потенциала адсорбата i, аi - термодинамическая активность адсорбата, dm i = RT d ln ai , получим:
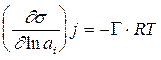
для Гиббсовской адсорбции это выражение принимает вид:
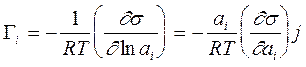 (3.7)
(3.7)
Уравнение (3.7). применяют только тогда, когда можно использовать концентрацию i-того компонента вместо активности и пренебречь изменениями концентраций других веществ. Этим условиям удовлетворяет разбавленный относительно данного компонента раствор. В таком растворе при изменении концентрации растворенного вещества практически не изменяется концентрация растворителя. Поэтому для растворенного вещества уравнение (3.7) переходит в широко используемые адсорбционные уравнения Гиббса для неэлектролитов и электролитов
Уравнение Гиббса для неэлектролитов:
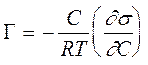 (3.8)
(3.8)
Для электролитов
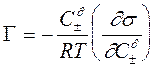 (3.9)
(3.9)
С термодинамической точки зрения – адсорбция –самопроизвольный процесс выравнивания химических потенциалов в объеме системы и поверхностном слое. Этот процесс происходит из-за сремления к минимуму поверхностной энергии (Gs).
Адсорбция это процесс взаимодействия молекул адсорбента с активными центрами поверхности адсорбента. Такое представление удобно (особенно для адсорбции на твердых адсорбентах), когда возникают трудности экспериментального определения поверхностного натяжения. Кроме того - возможность изучения природы адсорбционного взаимодействия.
Процессы адсорбции классифицируют в соответствии с типом взаимодействия адсорбата с адсорбентом.
Физико – химическая классификация.
1. физическая (молекулярная),
2. хемосорбция,
3. ионный обмен.
Наиболее широко распространена физическая адсорбция.
При физической адсорбции происходит взаимодействие адсорбата и адсорбента за счет сил Ван-дер-Ваальса и водородных связей. Силы Ван-дер-Ваальса включают три вида взаимодействия: диполь-дипольное, индукционное и дисперсионное. Для всех видов взаимодействия выполняется один закон изменения энергии притяжения от расстояния между атомами.
Uпр = -с/r6,
С = const.
На очень близких расстояниях действует энергия отталкивания:
Uот = b/rm,
B – const, m – обычно = 12.
Полная энергия:
U = b/r12 – c/r6.
При адсорбции происходит взаимодействие атома адсорбата с многими молекулами поверхности. То есть дисперсионные силы, которые вносят основной вклад во взаимодействие, обладают свойством аддитивности. То есть, чтобы рассчитать энергию взаимодействия при адсорбции, нужно провести суммирование всех энергий взаимодействия каждого атома адсорбата с каждым атомом поверхности.
Расчет упрощается при замене суммирования на интегрирование. При этом нужно предположить, что поверхность адсорбента имеет бесконечно большую площадь по сравнению с атомами адсорбата.
dUадс = Uпр×n×dV,
n – число атомов в единице объема адсорбента,
dV – приращение объема адсорбента.
dV можно определить через поверхность шарового сегмента:
S = 2prh = 2pr(r – x),
R – расстояние между атомами,
х – расстояние от поверхности.
dV = 2pr(r – x)dr
Так как Uпр = -c/r6, то dUадс = -(c/r6)×n×2pr(r – x)dr = -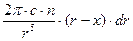
Проведем интегрирование этого выражения в пределах от r =х до r = ¥:
=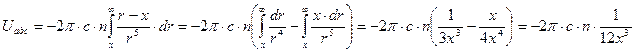 Окончательный результат:
Окончательный результат:
 ,
,
То есть энергия адсорбционного взаимодействия уменьшается с увеличением расстояния от поверхности.
Общее термодинамическое уравнение адсорбции – адсорбционное уравнение Гиббса. Часто оказывается удобным рассматривать распределение вещества между объемом и поверхностью с термодинамических позиций путем перехода от химических потенциалов к термодинамическим активностям. Такое рассмотерние справедливо для систем с газовой фазой и для растворов и не связано с изменением поверхностного натяжения.
При этом поверхностный слой рассматривают как отдельную фазу, в которой активности адсорбента выравнены. Чтобы получить простейшиен закономерности адсорбции, предполагают, что поверхность однородна и распределение адсорбата происходит в мономолекулярном слое.
УРАВНЕНИЕ ГЕНРИ, ФРЕЙНДЛИХА, ЛЕНГМЮРА.
Для описания процесса адсорбции, помимо фундаментального уравнения адсорбции Гиббса, применяют ряд других аналитических уравнений, которые называются по имени их авторов.
При незначительном заполнении адсорбента адсорбатом отношение концентрации вещества в адсорбционном слое и в объеме стремится к постоянному значению, равному кГ:
Г(А) = кГс (3.10).
Это уравнение характеризует изотерму адсорбции при малых концентрациях адсорбата (рис.3.1, участок 1) и является аналитическим выражением закона Генри. Коэффициент кГ не зависит от концентрации и представляет собой константу распределения, характеризующую распределение вещества в адсорбционном слое по отношению к его содержанию в объемной фазе. Уравнение Генри соблюдается приближенно, но это приближение достаточно для практики.
В более общем виде зависимость адсорбции от концентрации адсорбата можно определить с помощью уравнения Фрейндлиха.
Г(А) = кс1/n (3.11),
к, n -коэффициенты.
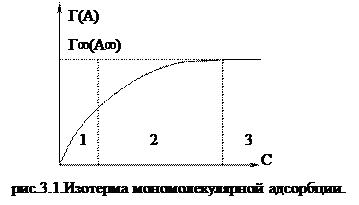 Это уравнение было получено на основе результатов обработки опытных данных по адсорбции поверхностно-активных веществ при концентрации адсорбата с = 1, к = Г. Коэффициент к численно равен величине адсорбции при с = 1.Коэффициент n характеризует отличие участка изотермы адсорбции (рис.3.1, участок 2) от прямой.
Это уравнение было получено на основе результатов обработки опытных данных по адсорбции поверхностно-активных веществ при концентрации адсорбата с = 1, к = Г. Коэффициент к численно равен величине адсорбции при с = 1.Коэффициент n характеризует отличие участка изотермы адсорбции (рис.3.1, участок 2) от прямой.
 |
Коэффициенты в уравнении Фрейндлиха можно определить графически, если прологарифмировать уравнение (3.11):
lgГ(А) = lgк + n1/nlgс (3.12),
Графическая зависимость приведена на рис.3.2.
Изотерма адсорбции, которая соответствует уравнению Фрейнлиха (рис.3.1, участок 2).
Аналитическое выражение адсорбции в зависимости от концентрации дано в теории Ленгмюра.
 |
В основу теории положены кинетические представления о процессе адсорбции в условиях равновесия.
Представим единицу площади на границе раздела фаз. Если молекула адсорбата занимает в поверхностном слое площадь В0, а число его молекул -n, то nВ0 - это площадь, которая приходится на все молекулы в расчете на единицу площади адсорбционного слоя. Поверхность, свободная от молекул адсорбата = (1 - nВ0), свободная площадь определяет возможность дальнейшего протекания адсорбции.
vа = кас(1 - nВ0) - скорость адсорбции (3.13)
vд = каnВ0 - скорость десорбции (3.14),
ка и кд - константы адсорбции и десорбции.
В условиях равновесия скорости прямого и обратного процессов равны, следовательно, обозначив константу равновесия через b, получим:
b = ка/кд = 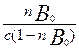 (3.15)
(3.15)
Константа равновесия связана со значением изобарно-изотермического потенциала:
DG0 = RТlnb
Проведем вспомогательные преобразования уравнения (3.15):
1/bс = (1 - nВ0)/nВ0 = 1/nВ0 - 1,
выразим число молекул адсорбата:
n = (1/В0)*bс/(1 + bс) (3.16)
В случае предельной адсорбции вся площадь занята молекулами:
n¥В0 = 1, n¥ - число молекул в насыщенном слое.
Степень насыщения q адсорбционного слоя:
q = nn¥ (3.17)
в процессе адсорбции:
0<q<1.
n = Г(А)NА, n¥ = Г¥(А¥)NА, тогда:
Г(А) = Г¥(А¥)*bс(1 + bс) (3.18)
(3.18). - уравнение Ленгмюра (рис.3.1, участок 3.)
|
|
Дата добавления: 2014-01-13; Просмотров: 538; Нарушение авторских прав?; Мы поможем в написании вашей работы!