
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомная масса. Молекулярная масса. Молярная масса
|
|
|
|
В настоящее время атомная масса – одна из фундаментальных характеристик химического элемента. Она служит основой для всевозможных стехиометрических расчетов по химическим формулам и уравнениям, вычисления молекулярных масс химических соединений. Понятие атомной массы приложимо не только к элементам (элементная масса), но и к отдельным изотопам (изотопная масса).
Все физико-химические методы определения атомных масс дают величину элементной массы. Только для моноизотопных элементов, представленных единственным природным изотопам, элементная масса совпадает с изотопной. Современные точные физические методы установления атомных масс (например, масс-спектроскопия) позволяют получать значения изотопных масс. Поэтому для установления атомной (элементной) массы необходимо еще знать изотопный состав элемента.
Долгое время в качестве единицы атомной массы была принята 1/16 средней массы атомов природного кислорода, состоящего из изотопов 16О, 17О и 18О. Эта единица составляла основу химической шкалы атомных масс. В основе же физической шкалы лежала 1/16 массы изотопа 16О. Переходный множитель от одной шкалы к другой 1,000275. Существование двух шкал атомных масс создавало определенные трудности. Разница между ними намного превышает точность определения атомных масс современными физическими и физико-химическими методами. В 1916 г. Международный союз по теоретической и прикладной химии (IUPAC) утвердил единую углеродную шкалу атомных масс. Основа ее – атомная единица массы (а.е.м.), равна 1/12 массы изотопа углерода 12С. По углеродной шкале относительные атомные массы водорода и кислорода соответственно равны 1,00798 и 15,9994. Таким образом, атомная (элементная) масса – среднее значение массы атома химического элемента, выраженное в атомных единицах массы. Молекулярная масса – масса молекулы, выраженная в атомных единицах массы; она равна сумме масс всех атомов, из которых состоит молекул (молекулярная масса в действительности представляет собой среднюю массу молекулы с учетом изотопного состава элементов, образующих данное соединение).
|
|
|
В химии практически важной единицей количества вещества является моль. В 1 моль содержится столько структурных единиц (атомы, молекулы или др.), сколько атомов в 12 г изотопа углерода 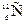 . Число структурных единиц, содержащихся в 1 моль вещества, равно 6,022×1023моль–1(постоянная Авогадро). Масса 1 моль данного вещества, выраженная в граммах, называется его молярной (мольной) массой. Так, молярная масса молекулярного кислорода равна 31,9988 г/моль, а атомарного водорода – 1,0079 г/моль. Молярная масса вещества в граммах численно равна его молекулярной (атомной) массе, выраженной в атомных единицах массы.
. Число структурных единиц, содержащихся в 1 моль вещества, равно 6,022×1023моль–1(постоянная Авогадро). Масса 1 моль данного вещества, выраженная в граммах, называется его молярной (мольной) массой. Так, молярная масса молекулярного кислорода равна 31,9988 г/моль, а атомарного водорода – 1,0079 г/моль. Молярная масса вещества в граммах численно равна его молекулярной (атомной) массе, выраженной в атомных единицах массы.
Закон постоянства состава. Состав молекулярного соединения остается постоянным независимо от способа его получения. В отсутствие молекулярной структуры его состав зависит от условий получения и предыдущей обработки. Возьмем, к примеру, аммиак (NH3). Независимо от способов получения (прямой синтез из простых веществ, разложение аммонийных солей, действие кислот на нитриды активных металлов и т.п.), состав молекулы аммиака всегда постоянен и неизменен: на атом азота приходится три атома водорода. А для оксида титана (+2) состав соединения зависит от условий получения и предыдущей обработки. В молекуле аммиака, состоящей лишь из четырех атомов, исключается изменчивость состава.
Оксид же титана (+2) представляет собой фазу, состоящую из огромного числа атомов (порядка постоянной Авогадро), которая и определяет свойства этого соединения. Это ярчайший пример перехода количества в качество: коллектив из колоссального числа частиц обладает уже новым качеством – непостоянством состава.
|
|
|
Закон эквивалентов. Вещества вступают в химические реакции в строго определенных массовых соотношениях, пропорциональных их эквивалентам.
Эквивалентом называется реальная или условная частица вещества, которая в кислотно-основных реакциях эквивалентна одному иону водорода, а в окислительно-восстановительных реакциях – одному электрону.
В химии обычно пользуются понятием эквивалентная масса (mэ), т.е. массой 1 эквивалента вещества. Размерность эквивалентной массы – г/моль. Эквивалентная масса элемента определяется как отношение атомной массы к его валентности:
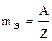 .
.
Так, эквивалентная масса серы в SO2 и в SO3 определяется как 32/4 и 32/6 г/моль.
Эквивалентная масса кислоты равна отношению молярной массы кислоты к числу атомов водорода в ней, которые она способна отдавать в раствор при диссоциации:
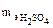 = 98/2 = 49 г/моль;
= 98/2 = 49 г/моль;  = 36,5/1 = 36,5 г/моль.
= 36,5/1 = 36,5 г/моль.
 г/моль (СН3СООН ↔СН3СОО- + Н+).
г/моль (СН3СООН ↔СН3СОО- + Н+).
Эквивалентная масса гидроксида равна отношению молярной массы к числу гидроксильных групп:
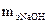 = 40/1 = 40 г/моль;
= 40/1 = 40 г/моль;  = 74 г/моль.
= 74 г/моль.
Эквивалентная масса оксида и соли определяется как отношение молярной массы соединения к произведению числа атомов элемента на его валентность:
 = 44/1×4 = 11 г/моль;
= 44/1×4 = 11 г/моль;  = 342/2×3 = 57 г/моль.
= 342/2×3 = 57 г/моль.
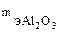 = 197,82/2×3 = 32,97 г/моль.
= 197,82/2×3 = 32,97 г/моль.
Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, може т иметь различные значения и зависят от того, в какую реакцию вступает это вещества. Так, в реакции Са(ОН)2+HCl =СаOHCl+H2O участвует только один атом водорода, поэтому
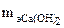 = 74/1 = 74 г/моль,
= 74/1 = 74 г/моль,
а в реакции 2NaOH + H3PO4=Na2HPO4 + 2H2O;
 = 98/2 = 49 г/моль, так как в ней участвует только 2 катиона водорода из трех.
= 98/2 = 49 г/моль, так как в ней участвует только 2 катиона водорода из трех.
Математические выражения закона эквивалентов записываются следующим образом:
 или
или 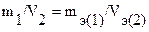 ,
,
где m1 и m2 – масса 1-го и 2-го вещества;
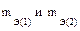 – эквивалентная масса 1-го и 2-го вещества;
– эквивалентная масса 1-го и 2-го вещества;
V2 и Vэ(2) – объем и эквивалентный объем 2-го вещества.
Второе выражение применяется, когда одно из реагирующих веществ находится в газообразном состоянии. При этом эквивалентный объем для водорода равен 11,2 дм3/моль, а для кислорода – 5,6 дм3/моль, исходя из молярного объема газа 22,4 дм3 при нормальных условиях.
|
|
|
Пример 1. Вычислите эквивалентную массу кислоты, 2 г которой содержат 0,1 г водорода, способного замещаться на металл.
Решение. По закону эквивалентов: m1/m2 = mэ(1)/mэ(2) Подставляем данные задачи в выражение и получаем:
mэ(1) = m1×mэ(2)/m2 = 2 × 1/ 0,1 = 20 г/моль.
Пример 2. На восстановление 2 г оксида металла израсходовано 920 см3 водорода, измеренного при нормальных условиях. Вычислите эквивалентные массы оксида и металла.
Решение. Исходя из закона эквивалентов: m1/V2 = mэ(1) / Vэ(2), где эквивалентный объем водорода равен 11,2 дм3/моль, получаем
mэ =m1× Vэ(2) / V2 = 2 × 11,2/ 0,92 = 24,3 г/моль.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 2742; Нарушение авторских прав?; Мы поможем в написании вашей работы!