
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Объемы потребления кислорода воздуха и выделения различных веществ при полном сгорании 1 кг топлива, кг
|
|
|
|
| Топливо | Потребление О2 | Выход веществ в результате сгорания | ||
| Н2О | N2 | CO2 | ||
| Водород Сжатый природный газ Сжиженный нефтяной газ Метанол Диметилэфир Бензин Дизтопливо Мазут Каменный уголь | 7,94 3,13 3,47 1,5 1,92 3,04 3,34 3,17 2,48 | 8,94 2,25 1,59 1,13 1,08 1,46 1,29 0,78 - | 26,41 13,28 12,0 4,98 - 11,74 11,39 10,4 8,86 | - 2,8 3,0 1,37 1,84 3,1 3,16 3,5 3,0 |
В результате полного сгорания топлива потребляется 1,5—7,9 кг кислорода воздуха, а выделение СО2(для используемых в настоящее время топлив) составляет порядка З кг, воды 0,8—2,3 кг, азота 0,4—13,3 кг.
Неполное окисление. Если количество кислород будет меньше стехиометрического, то окисление будет неполным: часть углерода кислится лишь до СО, а часть водорода не сгорит вообще. Окисление углеводородной молекулы СхНуидет по уравнению
СхНу+[(w*x/2)+(1-w)x+e(1-w1)/4]O2=
=wxCO+(1-w)xCO2+yw1H2/2+y(1-w1)H2O/2, (19)
где w - массовая доля углерода, окислившегося до СО; w1 — массовая доля несгоревшего водорода.
В продуктах сгорания появляется несгоревший водород (NH2) и оксид углерода (Hсо). Тогда
Nco+Nco2=х; NH2+NH2O=y/2.

Рис. 5 - Фронт пламени при ламинарном (а) и турбулентном (б) и горении[5]
Ламинарное горение образуется при распространении фронта
пламени по неподвижной или ламинарно движущейся горючей смеси. Фронт пламени представляет собой узкую зону толщиной до
1 мм (δпл), отделяющую свежую смесь от продуктов сгорания
(рис. 2.4, а), в которой температура меняется практически линейно за счет конвективного теплообмена (теплового распространения пламени) путем прогрева свежей смеси от температуры То до температуры продуктов сгорания Тпс. Под воздействием излучения пламени перед фронтом в свежей смеси протекают фотохимические предпламенные процессы (на расстоянии до 5 мм от фронта) с образованием Н2, СО, СО2, Н2О и т. д.
|
|
|
При турбулентном движении горючей смеси крупные пульсации искривляют фронт пламени, разрывают его (рис. 5, б). Толщина фронта при атмосферном давлении значительно больше, чем у ламинарного (20-25мм). Скорость турбулентного горения зависит от интенсивности и масштабов турбулентности смеси.

Рис. 6 - Энергия активизации Еа и тепловой эффект прямой и обратной реакции
Отличительной особенностью физических и химических закономерностей процесса горения является наличие большого результирующего экзотермического эффекта химических реакций и температуры, определяющей скорости этих реакций. Ход химической реакции при изменении энергии молекулы от начального Ео до конечного Ек зна чений возможен, когда молекула имеет энергию, большую Ео (рис. 6). Если Ео>Ек, то в результате реакции выделяется теплота ∆Ǫ (экзотермическая реакция), иначе реакция сопровождается поглощением теплоты (эндотермическая). В принципе любая реакция может идти в обоих направлениях. На схеме для обратной реакции Еа(обр)- энергия активации, а ∆Ǫ - эндотермический эффект.
Скорость основных химических реакций в процессе горения vx зависит от концентраций топлива c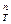 , окислителя с
, окислителя с , а также константы скорости i-й химической реакции kс и определяется по формуле Аррениуса
, а также константы скорости i-й химической реакции kс и определяется по формуле Аррениуса
vxi=kcic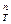 с
с , (20)
, (20)
где n,m — показатели порядка реакции по соответствующим компонентам.
Константа скорости химической реакции определяется по формуле
Kc=koexp[-Ea/(RT)], (21)
где ko – предэкспотенциальный множитель; R - универсальная газовая постоянная; exp[-Ea/(RT)] - множитель, характеризующий долю молекул, обладающих энергией большей, чем энергия активации Еа п ри температуре Т. Чем больше энергия активации, тем сильнее зависимость множителя от температуры, поэтому г о р е н и е можно определить как химическую реакцию с экзотермическим эффектом и высоким значением энергии активации.
|
|
|
При осуществлении химической реакции концентрации исходных компонентов обычно уменьшаются, а продуктов сгорания – увеличиваются. Поэтому наступает момент, когда скорости прямой обратной реакций становятся одинаковыми — наступает состояние химического равновесия. Поскольку обычно энергии активации прямой и обратной реакций различны, то с изменением температуры скорости прямой и обратной реакций изменяются в различной степени, а следовательно, изменяются и равновесные концентрации. При низких температурах равновесие может быть вообще не достигнуто, сгорание будет неполным, образуются продукты неполного сгорания в составе отработавших газов, которые при выбросе загрязняют окружающую среду. Обычно в горелочных устройствах полного сгорания топлива не происходит и кроме СО2, Н2О, N2, O2, SО2 в отработавших газах присутствуют продукты неполного сгорания твердые частицы (С) и другие токсичные вещества (всего более 280 наименований).
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 548; Нарушение авторских прав?; Мы поможем в написании вашей работы!