
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правила уравнивания окислительно-восстановительных реакций
|
|
|
|
(Применение закона сохранения заряда к окислительно-восстановительным реакциям)
1. В молекуле, как бы сложна она ни была, сумма степеней окисления атомов, связанных между собой, равна нулю, т.e. молекула всегда электронейтральна.
2. Если молекула состоит из одинаковых атомов (H2; O2; S6; P2), то степень окисления каждого из них равна нулю.
3. Степень окисления водорода во всех соединениях, кроме гидридов, равна плюс единице, в гидридах она равна минус единице.
4. Степень окисления кислорода равна минус двум
Это можно показать на конкретных примерах:
H+1Cl+5O3-6K+1Cl+7O4-8Na+1Cl-1 K3+3P+ 5O4-8
Порядок уравнивания окислительно-восстановительных реакций, т.е. приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
Метод электронного баланса
Для расстановки коэффициентов в окислительно-восстановительных реакциях по методу электронного баланса необходимо:
- найти окислитель и восстановитель и записать реакции присоединения и отдачи электронов;
- произвести баланс перенесенных зарядов;
- произвести уравнивание в соответствии с балансом заряда;
- проверить баланс по водороду;
- проверить соблюдения баланса по кислороду.
Например, запишем уравнение реакции получения хлора окислением соляной кислоты перманганатом калия:
 +
+ →
→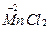 +
+ +KCl + H2O
+KCl + H2O
 В этой реакции хлорид-ион окисляясь, отдает один электрон, а Mn+7, восстанавливаясь, принимает пять электронов. Составляем электронные уравнения:
В этой реакции хлорид-ион окисляясь, отдает один электрон, а Mn+7, восстанавливаясь, принимает пять электронов. Составляем электронные уравнения:
 -
-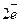 =
= 5
5
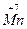 +
+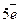 =
= 2
2
Полученные коэффициенты подставляем в схему реакции:
HCl + 2KMnO4 → 2MnCl2+5Cl2 + KCl + H2O,
Далее подбираем коэффициенты для кислотных остатков и водорода
16HCl + 2KMnO4 = 2MnCl2+5Cl2 + 2KCl + 8H2O.
Правильность расстановки коэффициентов проверяем по балансу кислорода.
|
|
|
Метод полуреакций (электронно-ионного баланса)
Метод полуреакций удобен при расстановке коэффициентов в ионных окислительно-восстановительных уравнениях. Принципы расстановки сходны с вышеприведенным методом, однако вместо элементов в уравнениях электронного баланса используются ионы. Например, рассмотрим реакцию взаимодействия сульфит- и перманганат-ионов в кислой среде:
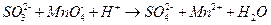
Восстановителем является сульфит-ион (он отдает электроны). Запишем уравнение его окисления (полуреакцию), дополняя недостающий кислород (слева) водой и водород (справа) ионами водорода:
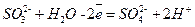
Перманганат-ион служит в этой реакции окислителем (он принимает электроны). Запишем полуреакцию и для него, используя тот же метод дополнения водой и ионами водорода:
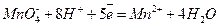
Теперь суммируя полученные полуреакции с учетом равенства отданных и принятых электронов, получаем сокращенное ионное уравнение данной реакции:
 |
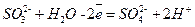 5
5
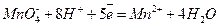 2
2
 |
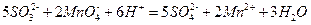
Дополняя левую и правую части уравнения одинаковыми количествами одноименных ионов можно легко перейти к молекулярному уравнению:
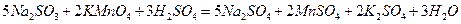
Как видно из рассмотренного выше в окислительно-восстановительных реакциях наблюдается перенос электронов (присоединение в процессе восстановления и отдача при окислении). В связи с этим они играют определяющую роль в электрохимических процессах. Попытаемся доказать, что в окислительно-всстановительных реакциях подобных тем, которые мы рассмотрели выше, действительно наблюдается перенос электронов. Для этого проведем эксперимент, схема которого представлена на рисунке 1.1.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1600; Нарушение авторских прав?; Мы поможем в написании вашей работы!