
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения теории электролитической диссоциации С.Аррениуса
1. При растворении молекулы неорганических и некоторых органических соединений диссоциируют на ионы.
HCl 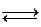 H+ + Cl- (4a)
H+ + Cl- (4a)
NaOH 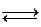 Na+ + OH- (4б)
Na+ + OH- (4б)
K2SO4 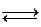 2K+ + SO4-2 (4в)
2K+ + SO4-2 (4в)
CH3COOH 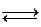 H+ + CH3COO - (4г)
H+ + CH3COO - (4г)
Это постулировалось, причины диссоциации не рассматривалась, не обсуждался также вопрос почему заряженные частицы не взаимодействуют друг с другом.
2. Диссоциация молекул на ионы не является полной, вводилась степень диссоциации a.
0 < a < 1
Соответственно доля неразложившихся частиц была 1 - a. Если ввести 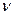 - стехиометрический коэффициент, т.е. коэффициент показывающий количество частиц, на которое диссоциирует данная молекула, то для реакции 4а, 4б, 4г
- стехиометрический коэффициент, т.е. коэффициент показывающий количество частиц, на которое диссоциирует данная молекула, то для реакции 4а, 4б, 4г  , а для реакции 4в
, а для реакции 4в 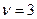 .Тогда можно записать:
.Тогда можно записать:
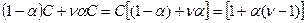
Это означает, что:
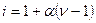 (4.4)
(4.4)
Поскольку 
 i > 1. Таким образом удалось количественно рассчитать величину изотонического коэффициента. Коэффициент a получил название кажущейся степени диссоциации.
i > 1. Таким образом удалось количественно рассчитать величину изотонического коэффициента. Коэффициент a получил название кажущейся степени диссоциации.
3. К процессу электролитической диссоциации как к любой химической реакции применим закон действующих масс. Предположим, протекает химическая реакция
А + В = С (4.д)
В состоянии равновесия не может быть произвольных соотношений между концентрациями веществ А, В и С, они определяются следующим выражением:
 , (4.5)
, (4.5)
где квадратные скобки означают концентрацию соответствующего компонента, а К – константа равновесия.
В общем случае для реакции

 (4.е)
(4.е)
константа будет равна:
 (4.6)
(4.6)
Запишем реакцию диссоциации какого-либо вещества:
МА 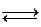 М+ + А- (4.ж)
М+ + А- (4.ж)
 (4.7)
(4.7)
Выразим концентрацию [ МА ] с учетом степени диссоциации: концентрацию недиссоциировавших частиц можно записать как
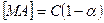 , (4.8)
, (4.8)
тогда концентрация распавшихся
 . (4.9)
. (4.9)
Подставив (4.8) и (4.9) в (4.7), получим:
 (4.10)
(4.10)
В частном случае для малодиссоциирующих электролитов ( ), получаем, что
), получаем, что
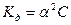 (4.11)
(4.11)
 (4.12)
(4.12)
Уравнения (4.10), (4.12) носят название законов разведения В.Оствальда. (В. Оствальд – российский (латвийский) физик, впоследствии лауреат Нобелевской премии).
Теория электролитической диссоциации нашла хорошее экспериментальное подтверждение, и за ее разработку в 1903г. С. Аррениус был удостоен Нобелевской премии. Между тем, у теории С. Аррениуса были свои недостатки:
1. неясен механизм диссоциации молекул на ионы;
2. непонятно отсутствие взаимодействий между заряженными частицами.
С критикой теории С.Аррениуса выступал известный русский ученный Д.И. Менделеев.
|
|
Дата добавления: 2014-01-13; Просмотров: 981; Нарушение авторских прав?; Мы поможем в написании вашей работы!