
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гормоны поджелудочной железы
|
|
|
|
ЛЕКЦИЯ 5. ПИЩЕВАРЕНИЕ
Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную и эндокринную. Экзокринная функция обеспечивает синтез и секрецию ферментов и ионов, необходимых для процессов пищеварения. Эндокринную функцию выполняют клетки островкового аппарата поджелудочной железы, которые секретируют гормоны, участвующие в регуляции многих процессов в организме.
В островковой части поджелудочной железы (островки Лангерханса) выделяют 4 типа клеток, секретирующих разные гормоны: А- (или α-) клетки секретируют глюкагон, В- (или β-) - инсулин, D- (или δ-) - соматостатин, F-клетки секретируют панкреатический полипептид.
1. ИНСУЛИН. СТРОЕНИЕ, СИНТЕЗ И СЕКРЕЦИЯ
Инсулин - полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками (рис. 11-23). Инсулин может существовать в нескольких формах: мономера, димера и гексамера. Гексамерная структура инсулина стабилизируется ионами цинка, который связывается остатками Гис в положении 10 В-цепи всех 6 субъединиц.
Молекула инсулина содержит также внутримолекулярный дисульфидный мостик, соединяющий шестой и одиннадцатый остатки в А-цепи. Инсулины некоторых животных имеют значительное сходство по первичной структуре с инсулином человека.
Бычий инсулин отличается от инсулина человека по трём аминокислотным остаткам, а инсулин свиньи отличается только на одну аминокислоту, которая представлена аланином вместо треонина на карбоксильном конце В-цепи.
В обеих цепях во многих положениях встречаются замены, не оказывающие влияния на биологическую активность гормона. Наиболее часто эти замены обнаруживаются в положениях 8, 9 и 10 цепи А.
|
|
|
В то же время в положениях дисульфидных связей, остатков гидрофобных аминокислот в С-концевых участках В-цепи и С- и N-концевых остатков А-цепи замены встречаются очень редко, что свидетельствует о важности этих участков для проявления биологической активности инсулина. Использование химических модификаций и замен аминокислот в этих участках позволили установить структуру активного центра
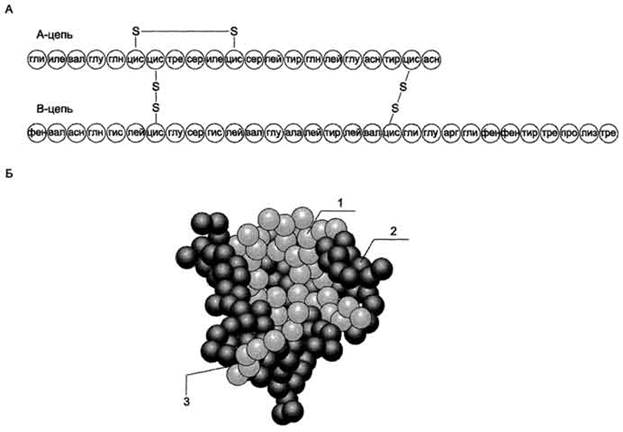
Рис. 11-23. Структура инсулина человека. А. Первичная структура инсулина. Б. Модель третичной структуры инсулина (мономер): 1 - А-цепь; 2 - В-цепь; 3 - участок связывания с рецептором.
инсулина, в формировании которого принимают участие остатки фенилаланина В-цепи в положениях 24 и 25 и N- и С-концевые остатки цепи А.
Биосинтез инсулина включает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате последовательного протеолиза превращаются в активный гормон. Биосинтез препроинсулина начинается с образования сигнального пептида на полирибосомах, связанных с ЭР. Сигнальный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи. После окончания синтеза препроинсулина сигнальный пептид, включающий 24 аминокислотных остатка, отщепляется (рис. 11-24).
Проинсулин (86 аминокислотных остатков) поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина (51 аминокислотный остаток) и С-пептида, состоящего из 31 аминокислотного остатка.
Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. Т1/2 инсулина в плазме крови составляет 3-10 мин, С-пептида - около 30 мин.
|
|
|

Рис. 11-24. Схема биосинтеза инсулина в β-клетках островков Лангерханса. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида.
Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках.
Регуляция синтеза и секреции инсулина. Глюкоза - главный регулятор секреции инсулина, а β-клетки - наиболее важные глюкозо-чувствительные клетки в организме. Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Действие глюкозы на скорость экспрессии генов может быть прямым, когда глюкоза непосредственно взаимодействует с транскрипционными факторами, или вторичным, через влияние на секрецию инсулина и глюкагона. При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, что сопровождается активацией транскрипции мРНК инсулина.
Синтез и секреция инсулина не являются строго сопряжёнными процессами. Синтез гормона стимулируется глюкозой, а секреция его является Са2+-зависимым процессом и при дефиците Са2+ снижается даже в условиях высокой концентрации глюкозы, которая стимулирует синтез инсулина.
Потребление глюкозы β-клетками происходит в основном при участии ГЛЮТ-1 и ГЛЮТ-2, и концентрация глюкозы в клетках быстро уравнивается с концентрацией глюкозы в крови. В β-клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой, имеющей высокую Кm, вследствие чего скорость её фосфорилирования почти линейно зависит от концентрации глюкозы в крови. Фермент глюкокиназа - один из важнейших компонентов глюкозо-чувствительного аппарата β-клеток, в который, помимо глюкозы, вероятно, входят промежуточные продукты метаболизма глюкозы, цитратного цикла и, возможно, АТФ. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета.
|
|
|
На секрецию инсулина влияют другие гормоны. Адреналин через α2-рецепторы тормозит секрецию инсулина даже на фоне стимуляции глюкозой, β-адренергические агонисты её стимулируют, вероятно, в результате повышения концентрации цАМФ. Этот механизм, полагают, лежит в основе действия гормонов ЖКТ, таких как секретин, холецистокинин и желудочный ингибирующий пептид (GIP), которые повышают секрецию инсулина. Высокие концентрации гормона роста, кортизола, эстрогенов также стимулируют секрецию инсулина.
2. БИОЛОГИЧЕСКИЕ ФУНКЦИИ ИНСУЛИНА
Инсулин - главный анаболический гормон. Он участвует в регуляции метаболизма, транспорта глюкозы, аминокислот, ионов, в синтезе белков. Инсулин влияет также на процессы репликации и транскрипции, участвуя таким образом в регуляции клеточной дифференцировки, пролиферации и трансформации клеток. Участие инсулина в регуляции метаболизма рассмотрено в соответствующих разделах (см. разделы 7, 8, 9). Влияние инсулина на ключевые ферменты метаболизма представлено в табл. 11-7.
Транспорт глюкозы в клетки происходит при участии специальных белков-переносчиков. Переносчик, регулируемый инсулином (ГЛЮТ-4), содержится только в мышцах и жировой ткани (инсулинзависимые ткани). В отсутствие инсулина ГЛЮТ-4 находятся в цитозольных везикулах. Под влиянием инсулина происходит транслокация везикул в плазматическую мембрану; при снижении концентрации гормона глюкотранспортёры возвращаются в цитозоль, и транспорт глюкозы прекращается.
В клетках печени инсулин индуцирует синтез глюкокиназы. В результате фосфорилирования концентрация свободной глюкозы в клетках поддерживается на низком уровне, что способствует её транспорту из крови по градиенту концентрации.
Влияние инсулина на метаболизм глюкозы. Инсулин стимулирует утилизацию глюкозы в клетках разными путями. Около 50% глюкозы используется в процессе Гликолиза, 30-40% превращается в жиры и около 10% накапливается в форме гликогена. Общий результат стимуляции этих процессов - снижение концентрации глюкозы в крови.
|
|
|
Влияние инсулина на метаболизм глюкозы осуществляется путём повышения активности и количества ключевых ферментов гликолиза: глюкокиназы, фосфофруктокиназы, пируват-киназы. В мышцах инсулин активирует гексокиназу П. В печени и мышцах под влиянием инсулина снижается концентрация цАМФ в результате активации фосфодиэс-теразы. Кроме того, инсулин активирует фос-фатазы, дефосфорилирующие гликогенсинтазу, в результате чего происходит активация синтеза гликогена и тормозится его распад.
Эффекты инсулина, обусловленные фосфорилированием и дефосфорилированием ферментов, проявляются очень быстро, в течение нескольких секунд и минут. Параллельно с активацией ферментов гликолиза инсулин тормозит глюконеогенез, репрессируя синтез ключевого фермента глюконеогенеза - фосфоенолпируваткарбок-сикиназы (ФЕП карбоксикиназы).
Влияние инсулина на метаболизм жиров. В печени и жировой ткани инсулин стимулирует синтез жиров, обеспечивая получение для этого процесса необходимых субстратов (ацетил-КоА, α-глицерофосфат и NADPH) из глюкозы. В адипоцитах инсулин активирует ацетил КоА-карбоксилазу и ЛП-липазу и индуцирует синтез синтазы жирных кислот, ацетил-КоА-карбоксилазы и ЛП-липазы. Инсулин в жировой ткани тормозит мобилизацию жиров. Он активирует фосфатазу, которая дефосфорилирует и тем самым инактивирует гормончувствительную ТАГ-липазу. Таким образом, под влиянием инсулина снижается концентрация жирных кислот, циркулирующих в крови. Инсулин стимулирует потребление нейтральных аминокислот в мышцах и синтез белков в печени, мышцах и сердце.
Инсулин стимулирует пролиферацию большого количества клеток в культуре тканей, а также, вероятно, может участвовать в регуляции роста in vivo. Для изучения регуляции роста чаще всего используют культуры фиброб-ластов. В таких клетках инсулин усиливает способность фактора роста фибробластов (FGF), тромбоцитарного фактора роста (PDGF), фактора роста эпидермиса (EGF), простагландина (PGF2α), вазопрессина и аналогов цАМФ активировать размножение клеток, остановленных в фазе G.
3. МЕХАНИЗМ ДЕЙСТВИЯ ИНСУЛИНА
Действие инсулина начинается с его связывания со специфическим гликопротеиновым рецептором на поверхности клетки-мишени. Рецепторы инсулина обнаружены почти во всех типах клеток, но больше всего их в гепатоцитах и клетках жировой ткани. Так как концентрация инсулина в крови составляет ~10-10 М, количество рецепторов, связанных с инсулином, зависит от их количества на мембране клетки. Клетки с разным содержанием рецепторов реагируют по разному на одну и ту же концентрацию гормона.
Инсулиновый рецептор (IR) постоянно синтезируется и разрушается. Т1/2 рецептора составляет 7-12 ч. При высокой концентрации инсулина в плазме крови, например, при ожирении, число инсулиновых рецепторов может уменьшаться, и клетки-мишени становятся менее чувствительными к инсулину, что может быть одной из причин сахарного диабета II типа.
Снижение чувствительности клеток к гормону (десенситизация) опосредуется 2 механизмами. Первый включает утрату рецепторов путём их интернализации. Комплекс инсулин-рецептор захватывается внутрь клетки эндоцитозом. В результате интернализации часть рецепторов подвергается разрушению в лизосомах, а часть возвращается в плазматическую мембрану. Второй механизм десенситизации - ковалентная модификация рецептора в результате фосфорилирования. Так, фосфорилирование IR по остаткам серина и треонина снижает его сродство к инсулину.
Рецептор инсулина относят к типу рецепторов, обладающих тирозинкиназной активностью. Стимулированное инсулином аутофосфорилирование β-субъединицы IR по остаткам тирозина приводит к фосфорилированию других внутриклеточных белков - субстратов инсулинового рецептора (IRS). Известно несколько таких субстратов: IRS-1, IRS-2, а также некоторые белки семейства STAT.
Главную роль в формировании ответной реакции клетки на инсулиновый сигнал играет IRS-1. IRS-1 - фосфопротеин, состоящий из более чем 1200 аминокислотных остатков. Часть остатков серина, тирозина и треонина фосфо-рилирована. При стимуляции инсулином степень фосфорилирования IRS-1 увеличивается и придаёт ему способность соединяться с другими цитозольными белками. Это приводит к активации нескольких сигнальных путей, представляющих каскад реакций активации специфических протеинкиназ. В результате активации протеинкиназ происходит фосфорилирование ферментов и факторов транскрипции, что составляет основу многочисленных эффектов инсулина.
Активация инсулином сигнального пути Ras. Белок, известный как Ras-белок, относят к семейству малых ГТФ-связывающих белков. В неактивном состоянии Ras-белок прикреплён к внутренней поверхности плазматической мембраны и связан с ГДФ. Стимуляция инсулином приводит к образованию активной ГТФ-связанной формы Ras (рис. 11-25).
Превращение Ras-белка в активную форму происходит при участии семейства белков, являющихся активаторами протеинкиназ и протеинкиназами и, так же, как Ras-белок, получившие свои названия от онкогенов. Один из субстратов инсулинового рецептора She участвует в образовании комплекса с небольшим цитозольным белком Grb. Образовавшийся комплекс взаимодействует с Ras-бел-ком. В этот комплекс включаются другие белки: GAP (от англ. GTP-ase activating factor - фактор, активирующий ГТФ:азу), GEF (от англ. GTP exchange factor - фактор обмена ГТФ) и SOS (от англ, son ofsevenless, названный по мутации гена у мушки дрозофилы). Два последних белка способствуют отделению ГДФ от Ras-белка и присоединению ГТФ. Активированный Ras соединяется с протеинкиназой Raf-1. Raf-1 в неактивном состоянии находится в цитозоле в соединении с шаперонами. Активация Raf-1 происходит в результате многоэтапного процесса, включающего присоединение белка к плазматической мембране, фосфорилирование и взаимодействие с рецептором инсулина. Активированная Raf-киназа стимулирует каскад реакций фосфорилирования и активации других протеинкиназ, в частности, митогенакти-вируемых протеинкиназ (МАПК). При участии Raf-1 сначала фосфорилируется и активируется киназа МАПК, которая, в свою очередь, фосфорилирует МАПК.
МАПК фосфорилирует многие цитоплазматические белки: протеинкиназу pp90S6, белки рибосом, фосфолипазу А2, активаторы транскрипции (ПСАТ). Путь Ras активируется не только инсулином, но и многими другими гормонами и факторами роста. Многие компоненты этого пути являются продуктами протоонкогенов, мутации которых приводят к злокачественной трансформации клеток.
Эффекты инсулина могут проявляться в течение секунд и минут (транспорт веществ, фосфорилирование и дефосфорилирование белков, активация и ингибирование ферментов, синтез РНК) или через несколько часов (синтез ДНК, белков, рост клеток).
Активация фосфоинозитол-3-киназы (ФИ-3-киназы). Этот фермент катализирует фосфорилирование
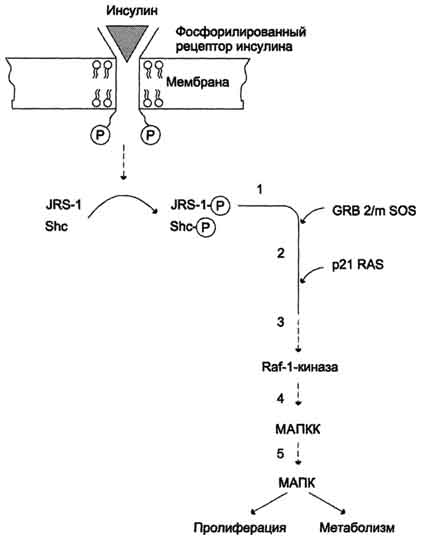
Рис. 11-25. Активация Ras-пути инсулином. 1 - GRB-2/mSOS - цитозольный белок нековалентно присоединяется к фосфо-рилированному рецептору инсулина при участии одного из субстратов инсулинововго рецептора - She; 2 - образовавшийся комплекс взаимодействует с белком Ras; в этот комплекс включаются также белки, которые обеспечивают отделение от Ras ГДФ и присоединение ГТФ; 3 - активированный Ras соединяется с протеинкиназой Raf-1, вследствие чего происходит активация Raf-1-киназы; 4, 5 - активированная Raf-1-киназа стимулирует каскад реакций фосфорилирования и активации других протеинкиназ, в частности, МАПКК и МАПК. МАПК фосфорилируют многие цитоплазматические белки и факторы транскрипции. МАПК - митогенактивируемые протеинкиназы.
ФИ, ФИ-4-фосфата и ФИ-4,5-бисфосфата в положении 3, образуя полифосфоинозитиды: ФИ-3-фосфат, ФИ-3,4-бисфосфат, ФИ-3,4,5-трифосфат, которые в разных клетках стимулируют мобилизацию Са2+ и активацию специфических протеинкиназ (см. раздел 5). Активация ФИ-3-киназы стимулирует транслокацию ГЛЮТ-4 в плазматическую мембрану и таким образом ускоряет трансмембранный перенос глюкозы в клетки жировой и мышечной ткани. В жировой ткани активация ФИ-3-киназы приводит к торможению липолиза. Снижение скорости липолиза происходит в результате активации фосфодиэстеразы и уменьшения внутриклеточной концентрации цАМФ (рис. 11-26).
Активация гликогенсинтазы инсулином. Одной из протеинкиназ, активируемых через путь Ras. является протеинкиназа pp90S6. Этот фермент фосфорилирует протеинфосфатазу, связанную с гранулами гликогена. При фосфорилировании протеинфосфатаза активируется и дефосфорилирует киназу гликогенфосфорилазы, гликогенфосфорилазу

Рис. 11-26. Активация фосфодиэстеразы адипоцитов инсулином. 1 - фосфорилированныи рецептор инсулина фосфорилирует субстраты инсулинового рецептора; 2 - образование комплекса фосфоинозитол-3-киназы (ФИ-3-киназы) с активированными субстратами инсулинового рецептора; 3 - активация протеинкиназы В (ПК-В); 4 - протеинкиназа В активирует фосфодиэстеразу (ФДЭ) путём фосфорилирования; 5 - ФДЭ катализирует реакцию превращения цАМФ в АМФ.
и гликогенсинтазу. Дефосфорилированные формы киназыфосфорилазы и гликогенфосфорилазы неактивны, вследствие чего мобилизация гликогена замедляется. Гликогенсинтаза, напротив, активируется, и синтез гликогена ускоряется (рис. 11-27).
Инсулин влияет на скорость транскрипции более, чем 100 специфических мРНК в печени, жировой ткани, скелетных мышцах и сердце. Впервые влияние инсулина на транскрипцию генов было показано на примере фосфоенолпируваткарбоксикиназы - ключевого фермента глюконеогенеза, скорость синтеза которого в культуре клеток гепатомы снижалась в течение нескольких минут.
4. ГЛЮКАГОН
Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клетках
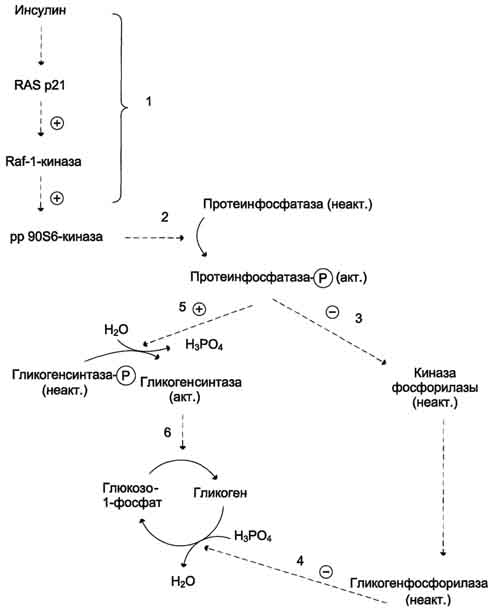
Рис. 11-27. Активация гликогенсинтазы инсулином. 1 - активация пути RAS; 2 - протеинкиназа ррЭОЗб, активируемая инсулином через путь RAS (рис. 11-25), фосфорилирует протеинфосфатазу гранул гликогена, которая включает каскад реакций дефосфорилирования; 3 - инактивация киназыфосфорилазы и гликогенфосфорилазы; 4 - торможение мобилизации гликогена; 5 - активация гликогенсинтазы; 6 - стимуляция синтеза гликогена.
островков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной железы главный пептид - глюкагон; в клетках кишечника образуются глюкагонопо-добные пептиды (от англ. GLP - glucagon like peptide): GLP-1, GLP-2, глицентин и другие. GLP-1 ингибирует секрецию глюкагона и стимулирует синтез и секрецию инсулина. Стимулятором секреции GLP-1 служит другой гормон - желудочный ингибирующий полипептид (от англ. GIF - gastrial inhibitor peptide), который синтезируется в клетках слизистой оболочки верхних отделов тонкого кишечника. Секреция GIP стимулируется при приёме пищи; наиболее сильным стимулятором служит глюкоза. На секрецию глюкагона влияют и многие другие соединения, включая аминокислоты, жирные кислоты, кетоновые тела и нейромедиаторы. При приёме пищи, богатой углеводами, секреция глюкагона снижается. Белковая пища стимулирует секрецию инсулина и глюкагона; однако некоторые аминокислоты в большей степени влияют на секрецию одного из них. Например, аланин стимулирует секрецию глюкагона, но не инсулина.
В плазме крови глюкагон не связан с каким-либо транспортным белком. Т1/2 гормона составляет ~5 мин. В печени глюкагон быстро разрушается под действием специфических протеаз.
Эффекты глюкагона в основном противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и жировая ткань. Связываясь с рецепторами на плазматической мембране клеток-мишеней, глюкагон повышает содержание цАМФ. В гепатоцитах это приводит к активации фосфорилазы гликогена и к снижению активности гликогенсинтазы. В результате ускоряется мобилизация гликогена. Фосфорилирование пируваткиназы и БИФ вызывает торможение гликолиза и ускорение глюконеогенеза. Кроме того, глюкагон стимулирует глюконеогенез, индуцируя синтез ферментов: глюкозо-6-фосфатазы, фосфоенол-пируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы. В клетках жировой ткани глюкагон через аденилатциклазный каскад активирует гормончувствительную ТАГ-липазу и стимулирует липолиз (см. раздел 8). Таким образом, в противоположность инсулину глюкагон стимулирует мобилизацию основных энергоносителей - углеводов и жиров.
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 887; Нарушение авторских прав?; Мы поможем в написании вашей работы!