
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Препараты кальция
|
|
|
|
Оссеин-гидроксиаппатитный комплекс
Остеогенон (Osteogenon). Представляет комплекс, содержащий около 444 мг гидроксиаппатита с физиологическим соотношением ионов кальция и фосфата (2:1), что обеспечивает максимально эффективную абсорбцию ионов кальция из ЖКТ. Кроме того, в состав остеогенона входит основной компонент органического матрикса кости – оссеин. Оссеин представлен коллагеном I типа и неколлагеновыми белками, среди которых трансформирующий фактор роста b, IGF-I и II, остеокальцин.
МД: Оказывает регулирующее действие на обмен костной ткани:
· Коллаген I типа включается в органическую матрицу кости, а кальций обеспечивает ее минерализацию.
· Остеокальцин связывает циркулирующий в крови кальций и облегчает его включение в состав гидроксиаппатита.
· IGF-I и II оказывают стимулирующее влияние на остеобласты и продукцию ими коллагена.
· Трансформирующий фактор роста b оказывает тормозящее действие на функцию остеокластов.
ФЭ: Остеогенон стимулирует образование и минерализацию костной ткани, тормозит резорбцию костей. При применении остеогенона увеличивается уровень ионов кальция и фосфатов в крови.
Показания к применению и режимы дозирования: Остеогенон применяют для лечения и профилактики остеопороза различного генеза (постменопаузального, стероидного, гепаринового, остеопороза беременных и др.). Назначают по 2-4 таблетки 2 раза в день. Длительность курса составляет от 2 месяцев до 2 лет.
НЭ: Нежелательные эффекты не отмечены, описаны единичные случаи диареи.
ФВ: таблетки по 800 мг.
О физиологической роли ионов кальция и их поступлении в организм человека уже было рассказано выше. В медицинской практике для коррекции нарушений уровня кальция используют ряд его органических и неорганических солей. В таблице 4 показано содержание элементарного кальция в некоторых из них.
|
|
|
Таблица 4. Содержание кальция в некоторых его солях.
| соль кальция | содержание элементарного кальция | количество таблеток, содержащее 1,5 г Са2+ | |
| в мг на 1 грамм соли | в 1 таблетке, мг | ||
| Карбонат Хлорид Фосфат двуосновной Цитрат | 230-290 | ||
| Глицерофосфат Лактат Глюконат | 95,5 |
Показания к применению:
1. Гипокальциемия (снижение уровня кальция в крови) любого генеза. При тяжелой гипокальциемии следует использовать внутривенное введение хлорида или глюконата кальция в дозе до 1,0 г/сут. В случаях умеренной гипокальциемии можно ограничиться пероральным введением кальция в дозе 1,0-1,5 г/сут.
2. Лечение остеопороза. Используют пероральное введение солей кальция в дозе 1,0-1,5 г/сут (на фоне богатой кальцием диеты!).
3. Лечение отравлений солями магния, щавелевой и плавиковой кислотами. Используют внутривенное инфузионное введение 1,0-1,5 г солей кальция непрерывно в течение 6-8 часов, при необходимости инфузию повторяют.
НЭ:
· При быстром внутривенном введении возможен флебит, приливы крови и ощущение жара в верхней половине туловища.
· При подкожном введении хлорида кальция возможен некроз подкожной клетчатки. Помощь заключается в частичном удалении хлорида кальция из места инъекции, не смещая иглы шприца. В последующем место инъекции следует обколоть раствором сульфата магния и новокаином, местно положить сухое тепло.
· При приеме внутрь (особенно карбоната кальция) возможно развитие запора, боли в животе, вследствие раздражения желудка.
· Гиперкальциемия.
ФВ: кальция карбонат – таблетки шипучие по 4,2 г;
кальция хлорид – раствор 10% в ампулах по 10 мл;
кальция глицерофосфат – таблетки по 0,5 г;
кальция глюконат – таблетки по 0,5 г;
|
|
|
кальция лактат – таблетки по 0,5 г.
ПРЕПАРАТЫ ГОРМОНОВ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
И ПЕРОРАЛЬНЫЕ САХАРОПОНИЖАЮЩИЕ СРЕДСТВА.
Можно сказать, что было бы весьма желательно найти замену подкожному введению инсулина, однако до сих пор никакой альтернативы этому нет.
R. Priesel, R. Wagner, 1932
Поджелудочная железа сочетает функции как эндокринной, так и экзокринной железы. Экзокринная функция заключается в выработке пищеварительного сока, который выделяется в двенадцатиперстную кишку и содержит сумму ферментов, необходимых для переваривания белков (трипсин, химотрипсин, коллагеназа, элластаза и др.), жиров (фосфолипаза, триглицеридлипаза, холестеролэстераза), углеводов (a-амилаза, сахараза, мальтаза, галактаза) и нуклеиновых кислот (эндонуклеазы, ДНК-азы, РНК-азы).
Эндокринную функцию поджелудочной железы выполняют особые скопления эндокринных клеток – островки Лангерганса. В ткани железы располагается около 1 млн. островков. Островки содержат клетки 4 типов, которые вырабатывают по крайней мере 5 видов гормонов (см. таблицу 1).
Таблица 1. Гормоны, продуцируемые поджелудочной железой и их функция.
| Тип клеток | Гормон | Функция |
| a-клетки | Глюкагон | Усиление гликогенолиза и липолиза. |
| b-клетки | Инсулин Амилин | Усиление гликолиза, синтеза гликогена, белка, липидов; торможение гликогенолиза и липолиза. Торможение захвата глюкозы b-клетками, секреции инсулина, конверсия проинсулина в инсулин |
| d-клетки | Соматостатин | Торможение секреции инсулина, глюкагона, СТГ, гастрина, соляной кислоты |
| РР-клетки | Панкреатический пептид | Торможение секреции инсулина, пепсина, соляной кислоты. |
Недостаточность эндокринной функции поджелудочной железы. Наиболее важной патологией с клинической точки зрения является сахарный диабет.
Сахарный диабет – эндокринное заболевание, обусловленное абсолютной или относительной недостаточностью инсулина, которая приводит к нарушению всех видов обмена веществ, поражению сосудов (ангиопатии) и нервов (нейропатии). Под абсолютной инсулиновой недостаточностью понимают снижение секреции инсулина b-клетками поджелудочной железы, тогда как под относительной – понижение чувствительности к инсулину периферических тканей на фоне нормальной или даже повышеннной секреции инсулина.
|
|
|
Согласно современной клинической классификации различают 2 основных типа заболевания:
· Инсулинзависимый сахарный диабет (ИЗСД или диабет I типа);
· Инсулиннезависимый сахарный диабет (ИНСД или диабет II типа).
Особенности каждого из этих типов диабета представлены в таблице 2.
Таблица 2. Сравнительная характеристика типов сахарного диабета.
| Критерий | ИЗСД | ИНСД |
| Дебют заболевания | моложе 30 лет | старше 30 лет |
| Семейный характер заболевания | редко | часто |
| Связь с генами HLA | четкая | возможна? |
| Другие аутоиммунные заболевания | иногда возможны | отсутствуют |
| Вес пациента | нормальный или понижен | избыточный |
| Недостаточность инсулина | абсолютная | относительная |
| Кетоацидоз | часто | редко |
| Потребность лечения инсулином | обязательна у всех | у отдельных лиц |
| Распространенность в популяции | 0,5% | 5% |
Классификация противодиабетических средств:
I. Средства заместительной терапии:
1. Препараты инсулина.
2. Модифицированные инсулины: лизпроинсулин, инсулин аспарт, гларгининсулин.
II. Средства, стимулирующие секрецию инсулина из b-клеток поджелудочной железы (секретагоги):
1. Производные сульфонилмочевины:
A I поколения: карбутамид, толбутамид;
B II поколения: глибенкламид, гликвидон, глипизид;
C III поколения: глимепирид.
2. Производные бензойной кислоты: репаглинид, натеглинид
III. Средства, повышающие чувствительность периферических тканей к инсулину (периферические сенситайзеры):
1. Производные бигуанида: метформин.
2. Производные тиазолидиндиона: пиоглитазон, розиглитазон.
IV. Средства, снижающие абсорбцию углеводов в кишечнике:
1. Ингибиторы a-глюкозидаз: акарбоза, воглибоза;
2. Производные смол: гуарем.
Инсулин (Insuline). Инсулин человека – небольшой белок с Mr=5.808 Да, состоящий из 51 аминокислоты. Инсулин образуется в b-клетках поджелудочной железы в виде препроинсулина, который содержит 110 аминокислот. После выхода из эндоплазматической сети от молекулы отщепляется N-концевой сигнальный пептид из 24 аминокислот и образуется проинсулин. В комплексе Гольджи путем протеолиза из середины молекулы проинсулина удаляются 4 основные аминокислоты и С-пептид из 31 аминокислоты. В итоге, образуется 2 цепи инсулина – А-цепь из 21 аминокислоты (содержит дисульфидную связь) и В-цепь из 30 аминокислот. Между собой А и В цепи соединяются 2 дисульфидными связями. В дальнейшем в секреторных гранулах b-клеток инсулин депонируется в виде кристаллов, состоящих из 2 атомов цинка и 6 молекул инсулина. В целом поджелудочная железа человека содержит до 8 мг инсулина, что примерно соответствует 200 ЕД инсулина.
|
|
|
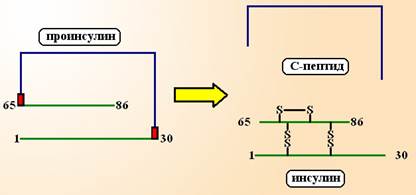
Схема 1. Образование инсулина. В процессе протеолиза от проинсулина отщепляется видоспецифичный С-пептид и 4 оснóвные аминокислоты (показаны красным).
Секреция инсулина. b-клетки поджелудочной железы содержат в своей мембране большое количество К+-каналов, которые находятся в открытом состоянии и обеспечивают постоянный выход ионов калия из клетки и гиперполяризацию ее мембраны.
Основным стимулятором секреции инсулина является глюкоза (см. рис. 2). При повышении концентрации глюкозы более 5 ммоль/л она при помощи переносчика GLUT-2 поступает внутрь b-клеток и подвергается фосфорилированию ферментом глюкокиназой. Глюкокиназа – особый фермент, который содержится только в клетках печени и поджелудочной железы, он имеет относительно низкое сродство к глюкозе (Km»10-20 мМ), поэтому фосфорилирует глюкозу только в том случае, если ее концентрация достаточно высока. В остальных клетках нашего организма фосфорилирование глюкозы осуществляется гексокиназой – ферментом, который имеет высокое сродство к глюкозе (Km»1-2 мМ) и активируется даже небольшим количеством глюкозы.

Схема 2. Регуляция секреции инсулина. Г – глюкоза, GLUT-2 – глюкозный транспортер, Г-киназа – глюкокиназа, обеспечивающая фосфорилирование глюкозы до глюкозо-6-фосфата (Г-6-Ф), который включается в ЦТК с образованием в итоге АТФ. Молекулы АТФ блокируют калиевые канала мембраны b-клеток и гиперполяризующий ток калия прекращается, а мембранный потенциал понижается. Уменьшение мембранного потенциала способствует открытию кальциевых каналов, поступлению ионов кальция в клетку и секреции инсулина (Ins).
После фосфорилирования глюкозы в b-клетках она включается в ЦТК и обеспечивает синтез молекул АТФ, которые соединяются со специальными рецепторами внутренней поверхности калиевого канала и закрывают его. В итоге, ток ионов калия из клетки прекращается и развивается небольшая деполяризация мембраны, которая приводит к открытию Са2+-каналов. Ионы кальция поступают в клетку и выполняют роль стимулятора секреции приводя к выбросу инсулина в кровь.
После того, как под влиянием инсулина уровень глюкозы понизится, активность переносчика GLUT-2 падает и транспорт глюкозы в b-клетки прекращается, уровень глюкозы в цитоплазме клетки также понижается. Глюкокиназа не может провести фосфорилирование глюкозы и синтез АТФ в b-клетках ослабевает, калиевые каналы освобождаются от молекул АТФ и вновь открываются, что приводит к возобновлению тока ионов калия из клетки и гиперполяризации ее мембраны. Секреция инсулина падает.
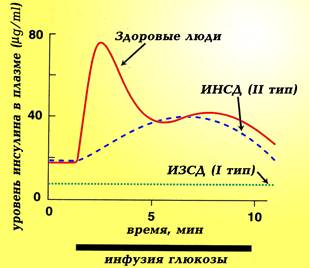
Схема 3. Постпрандиальная секреция инсулина у человека. У здорового человека в секреции инсулина имеется ранняя фаза и поздняя фаза. У лиц, которые страдают ИНСД сохраняется только поздняя фаза, а у пациентов с ИЗСД выпадают обе фазы.
b-клетки поджелудочной железы постоянно высвобождают небольшое количество инсулина (даже при низком уровне глюкозы в крови) – это так называемая «базальная секреция», которая составляет 1 ЕД/час. После приема пищи секреция инсулина нарастает одновременно с уровнем гликемии (уровнем глюкозы в крови) и составляет 4-6 ЕД/ч – это так называемая постпрандиальная секреция инсулина. В постпрандиальной секреции различают 2 фазы – раннюю и позднюю (см. рис. 3). У пациентов с ИЗСД отсутствуют обе фазы секреции инсулина, тогда как у больных ИНСД вторая фаза сохраняется, но становится более сглаженной.
Метаболизм и деградация инсулина. Период полуэлиминации инсулина после его выделения в кровь составляет всего 5-6 минут. Основными органами, где происходит разрушение инсулина являются печень, почки и скелетные мышцы. Деградация инсулина происходит под влиянием инсулиназы (расщепляет дисульфидные связи) и дигидропептидазы II типа (ангиотензинпревращающий фермент, который расщепляет В-цепь инсулина).
Поскольку кровь от поджелудочной железы по системе воротной вены поступает в печень, то 50-60% инсулина так и не достигают органов-мишеней и подвергаются разрушению при первом прохождении через гепатоциты, оставшиеся 35-40% инсулина элиминируются почками. У пациентов с диабетом, которые получают подкожные инъекции инсулина его элиминация носит нефизиологический характер: более 50-60% инсулина элиминируется почками и только 35-40% печенью.
Механизм действия инсулина. Инсулин действует на трансмембранные инсулиновые рецепторы, расположенные на поверхности тканей мишеней (скелетные мышцы, печень, жировая ткань) и активирует эти рецепторы.
Инсулиновый рецептор содержит 2 субъединицы: a-субъединицу, которая расположена с внешней стороны мембраны и b-субъединицу, которая прошивает мембрану насквозь. При связывании инсулина с рецепторами происходит их активация, при этом молекулы рецепторов объединяются попарно и приобретают тирозинкиназную активность (т.е. способность фосфорилировать остатки тирозина в молекулах ряда белков). Активированный рецептор подвергается аутофосфорилированию и в результате его тирозинкиназная активность усиливается в десятки раз. В дальнейшем сигнал с рецептора передается двумя путями:
· Немедленный ответ (развивается через несколько минут). Связан с фосфорилированием остатков тирозина в белке IRS-2, который активирует фосфатидилинозитол-3-киназу (PI-3 киназа). Под влиянием этой киназы молекулы фосфатидилинозитол бифосфата (PIP2) фосфорилируются до фосфатидилинозитол трифосфата (PIP3). PIP3 активирует ряд протеинкиназ, которые влияют на:
Þ активность трансмембранных транспортеров питательных веществ;
Þ активность внутриклеточных ферментов метаболизма углеводов и жиров;
Þ транскрипцию в ядре клетки ряда генов.
· Замедленный ответ (развивается через несколько часов). Обусловлен фосфорилированием остатков тирозина в молекуле IRS-1, которая стимулирует митоген-активируемые протеинкиназы (МАРК) и запускает процесс роста клеток и синтеза ДНК.
Физиологические эффекты инсулина. Основным эффектом инсулина является его влияние на транспорт глюкозы в клетки. Через мембрану клеток глюкоза проникает путем облегченного транспорта за счет специальных переносчиков – транспортеров глюкозы GLUT. Различают 5 видов этих транспортеров, которые могут быть объединены в 3 семейства:
· GLUT-1,3,5 – транспортеры глюкозы в инсулиннезависимые ткани. Для работы этих транспортеров не требуется инсулин. Они имеют крайне высокое сродство к глюкозе (Km»1-2 мМ) и обеспечивают транспорт глюкозы в эритроциты, нейроны мозга, эпителий кишечника и почек, плаценту.
· GLUT-2 – транспортер глюкозы в инсулинрегулирующие ткани. Он также не требует для своей работы инсулина и активируется только при высоких концентрациях глюкозы, так как имеет к ней крайне низкое сродство (Km»15-20 мМ). Обеспечивает транспорт глюкозы в клетки поджелудочной железы и печени (т.е. в те ткани, где идет синтез и деградация инсулина). Он принимает участие в регуляции секреции инсулина при повышении уровня глюкозы.
· GLUT-4 – транспортер глюкозы в инсулинзависимые ткани. Этот транспортер имеет промежуточное сродство к глюкозе (Km»5 мМ), но в присутствии инсулина его сродство к глюкозе резко повышается и он обеспечивает захват глюкозы клетками мышц, адипоцитами, печенью.
Под влиянием инсулина происходит перемещение молекул GLUT-4 из цитоплазмы клетки в ее мембрану (увеличивается количество молекул переносчика в мембране), повышается сродство переносчика к глюкозе и она поступает внутрь клетки. В итоге, концентрация глюкозы в крови понижается, а в клетке возрастает.
В таблице 3 представлено влияние инсулина на обмен веществ в инсулинзависимых тканях (печени, скелетных мышцах, жировой ткани).
Таблица 3. Влияние инсулина на обмен веществ в органах мишенях.
| Орган | Мембранный эффект | Внутриклеточный эффект |
| Печень | “ транспорта глюкозы в клетку | · ” гликогенолиза (угнетает гликогенфосфорилазу); · “ синтеза гликогена (активирует глюкокиназу и гликогенсинтетазу); · ” глюконеогенез из аминокилот и глицерина (угнетает фосфоенолпируват карбоксикиназу) · “ гликолиз (активирует гексокиназу, которая фосфорилирует глюкозу и способствует ее удержанию в клетке, повышает активность фосфофруктокиназы и пируваткиназы). |
| · ” превращение жирных кислот в кетокислоты и синтез кетоновых тел (ацетоуксусной и b-оксимасляной кислот, ацетона). · “ синтез триглицеридов и ЛПОНП (транспортная форма липидов). | ||
| “ захват K+ и PO43- | ||
| Мышцы | “ транспорта глюкозы в клетку | · ” гликогенолиза (угнетает гликогенфосфорилазу); · “ синтеза гликогена (активирует глюкокиназу и гликогенсинтетазу). |
| “ транспорта аминокислот в клетку | · “ рибосомальный синтез белков; · “ синтез ДНК и РНК. | |
| Жировая ткань | “ транспорта глюкозы в клетку | · “ гликолиз с образованием диоксиацетонфосфата, необходимого для синтеза глицерина |
| “ транспорта жирных кислот в клетку | · “ липогенез и синтез триглицеридов из глицеролфосфата и жирных кислот (активирует ацетил-КоА- карбоксилазу); · “ активность липопротеидлипазы (высвобождение триглицеридов из липопротеинов). |
В целом для инсулина характерно анаболическое действие на процессы обмена белков, жиров и углеводов (т.е. усиление синтетических реакций) и антикатаболические эффекты (торможение распада гликогена и липидов).
Терапевтические эффекты инсулина при сахарном диабете связаны с тем, что инсулин нормализует транспорт глюкозы в клетку и устраняет все проявления диабета (таблица 4).
Таблица 4. Терапевтические эффекты инсулина.
| Проявления диабета | Действие инсулина |
| Гипергликемия – обусловлена нарушением транспорта глюкозы в клетку и ее накоплением в крови. | Нормализует транспорт глюкозы в клетку и ее внутриклеточное фосфорилирование, что способствует удержанию глюкозы в клетке. Уровень гликемии понижается. |
| Полиурия. Во время фильтрации в почках глюкоза выделяется в мочу и если ее уровень превышает возможность переносчиков в канальцах нефрона реабсорбировать глюкозу, ее излишек начинает выделяться с мочой. Повышается осмотическое давление мочи и это замедляет реабсорбцию воды – количество мочи резко увеличивается. | Инсулин нормализует уровень глюкозы в крови, выделение глюкозы в мочу снижается и переносчики полностью удаляют глюкозу из мочи. Осмотичность мочи падает и реабсорбция воды возвращается к норме. Диурез снижается. |
| Полидипсия. Потеря воды с мочой и увеличение уровня глюкозы в крови повышают осмотичность крови и активируют осморецепторы гипоталамуса, что проявляется возникновением жажды. | Нормализация диуреза обеспечивает сохранение жидкости в организме и осмотическое давление крови падает. Осморецепторы центра жажды в гипоталамусе не активны и потребление жидкости понижается. |
| Полифагия. Недостаток глюкозы в клетке приводит к дефициту субстратов для синтеза АТФ и возникновению чувства голода, несмотря на избыток глюкозы в крови («голод среди изобилия»). | Инсулин восстанавливает поступление глюкозы в клетку, синтез АТФ и нормализует аппетит. |
| Похудание. Недостаток субстратов для синтеза АТФ компенсаторно усиливает липолиз и b-окисление жирных кислот, как альтернативный источник энергии. | Инсулин восстанавливает поступление глюкозы в клетку и синтез АТФ гликолитическим путем, уменьшает липолиз и активирует липогенез. |
| Кетонемия. Для обеспечения клеток организма субстратами для синтеза АТФ печень начинает синтезировать кетоновые тела из ацетилКоА, который высвободился в ходе b-окисления жирных кислот. | Инсулин восстанавливает транспорт глюкозы в клетку и синтез АТФ гликолитическим путем, потребность в кетоновых телах устраняется и их синтез прекращается. |
| Полинейропатии и полиангиопатии. Избыток глюкозы в крови приводит к активации инсулиннезависимых путей ее метаболизма – глюкоза конвертируется в сорбитол (сорбитоловый шунт) и затем во фруктозу. Избыток сорбитола откладывается в тканях сосудов, нервов и хрусталика глаза. | Инсулином восстанавливается инсулинзависимый метаболизм глюкозы и активность сорбитолового шунта падает. |
| Пиодермия. Избыток глюкозы в крови приводит к гликозилированию белков клеток иммунной системы (иммуноглобулинов, интерферона и лизоцима). Это нарушает нормальное протекание иммунных реакций | Инсулин нормализует уровень глюкозы и прекращает гликозилирование белков, которые участвуют в иммунном ответе. |
Характеристика препаратов инсулина. В медицинской практике применяют 3 вида инсулинов – говяжий, свиной, человеческий. Инсулин быка отличается от инсулина человека всего 3 аминокислотами, тогда как инсулин свиньи – только одной аминокислотой. В связи с этим инсулин свиньи более гомологичен инсулину человека и менее антигенен, чем инсулин быка. В настоящее время во всех развитых странах не рекомендовано применять для лечения лиц больных диабетом говяжьи инсулины.
Таблица 5. Первичная структура инсулинов
| Вид инсулина | А-цепь | В цепь | ||||||
| Инсулин человека | Thr | Ile | Asn | Pro | Lys | Thr | - | - |
| Инсулин свиньи, зайца, собаки | Thr | Ile | Asn | Pro | Lys | Ala | - | - |
| Инсулин быка | Ala | Val | Asn | Pro | Lys | Ala | - | - |
| Лизпроинсулин | Thr | Ile | Asn | Lys | Pro | Thr | - | - |
| Аспартинсулин | Thr | Ile | Asn | Asp | Lys | Thr | - | - |
| Гларгининсулин | Thr | Ile | Gly | Pro | Lys | Thr | Arg | Arg |
Ксеногенные инсулины (говяжий, свиной) получают путем экстракции кислотно-спиртовым методом практически тем же принципом, что был предложен более 80 лет назад Бантингом и Бестом в Торонто. Однако, процесс экстракции усовершенствован и выход инсулина составляет 0,1 г на 1000,0 г ткани поджелудочной железы. Полученный экстракт содержит первоначально 89-90% инсулина, остальное составляют примеси – проинсулин, глюкагон, соматостатин, панкреатический полипептид, ВИП. Эти примеси делают инсулин иммуногенным (вызывают образование антител к нему), снижают его эффективность. Основной вклад в иммуногенность вносит проинсулин, т.к. его молекула содержит С-пептид, видоспецифичный у каждого из животных.
Коммерческие препараты инсулина подвергаются дополнительной очистке. Различают 3 вида инсулинов по степени очистки:
· Кристаллизованные инсулины – очищают путем многократной рекристаллизации и растворения.
· Монопиковые инсулины – получают путем очистки кристаллизованных инсулинов методом гель-хроматографии. При этом инсулин выходит в виде трех пиков: А – содержит эндокринные и экзокринные пептиды; В – содержит проинсулин; С – содержит инсулин.
· Монокомпонентные инсулины – многократно хроматографированные инсулины, часто с применением ионообменной хроматографии и метода молекулярных сит.
В таблице 6 приведены критерии чистоты каждого из типов инсулина. В настоящее время необходимо стремиться к применению только свиных монокомпонентных инсулинов, при невозможности применения инсулина человека.
Таблица 6. Критерии чистоты коммерческих препаратов инсулина.
| Коммерческий препарат | Примеси суммарно | Проинсулин |
| Кристаллизованный Монопиковый Монокомпонентный | более 1 % 0,1-1,0% менее 0,1% | более 0,025% 0,001-0,025% менее 0,001% |
Инсулин человека в принципе можно производить 4 способами:
· Полным химическим синтезом;
· Экстракцией из поджелудочных желез человека;
· Полусинтетическим путем;
· Генноинженерным синтезом.
Первые 2 из перечисленных способов в настоящее время не применяются ввиду неэкономичности полного синтеза и недостатка сырья (поджелудочных желез человека) для массового получения инсулина вторым способом.
Полусинтетический инсулин получают из свиного путем ферментативной замены аминокислоты аланина в положении 30 В-цепи на треонин. В последующем полученный инсулин подвергается хроматографической очистке. Недостатком этого метода является зависимость производства инсулина от исходного сырья – свиного инсулина.
Генноинженерные инсулины получают в настоящее время по методам, которые разработаны тремя ведущими фармацевтическими корпорациями на рынке инсулиновых препаратов: Elly Lylli, Novo Nordisk и Aventis.
Elly Lylli – первая фирма, которая начала производство генноинженерного инсулина человека с 1987 г. Она работает с человечеким геном инсулина, который внедрен в геном кишечной палочки (E. coli). Кишечная палочка осуществляет синтез проинсулина человека, который после ферментативного отщепления С-пептида превращается в инсулин.
Novo Nordisk – пользуется химерным (искусственным) геном «мини-проинсулина», т.е. такого инсулина в котором С-пептид значительно короче, чем у инсулина человека. Химерный ген помещен в клетки пекарских дрожжей, которые синтезируют проинсулин, после чего от него отщепляют мини-С-пептид.
Aventis производит инсулин человека, пользуясь геномом обезьяны макаки (Macaca fascicularis), ген которой идентичен гену инсулина человека. При помощи мРНК получают клоны ДНК этого гена и инкорпорируют его в клетки E. coli.
Активность препаратов инсулина выражают биологическими методами в ЕД. За 1 ЕД принимают такое количество инсулина, которое снижает концентрацию глюкозы в крови у кролика натощак на 45 мг/дл или вызывает гипогликемические судороги у мышей. 1 ЕД инсулина утилизирует около 5,0 г глюкозы крови. 1 мг международного стандарта инсулина содержит 24 ЕД. Первые препараты содержали 1 ЕД в мл, современные коммерческие препараты инсулина выпускаются в виде 2 концентраций:
· U-40 – содержат 40 ЕД/мл. Такая концентрация используется при введении инсулина при помощи обычного шприца, а также у детей.
· U-100 – содержит 100 ЕД/мл. Такая концентрация используется при введении инсулина с помощью шприца-ручки.
Номенклатура препаратов инсулина. В зависимости от длительности действия препараты инсулина разделяют на несколько групп:
1. Инсулины короткого действия (простые инсулины);
2. Продленные инсулины (инсулины средней длительности действия);
3. Инсулины длительного действия;
4. Смешанные инсулины (готовые смеси инсулинов короткого и продленного действия).

Схема 4. Профили действия простых и комбинированных препаратов инсулина
Инсулины короткого действия. Представляют собой раствор чистого инсулина или инсулина с небольшим количеством ионизированного цинка. После подкожного введения эти инсулины начинают действовать через 0,5-1,0 ч, максимум их действия приходится на 2-3 ч и продолжительность гипогликемизирующего действия составляет 6-8 часов. Препараты этой группы являются истинными растворами, их можно вводить подкожно, внутримышечно и внутривенно. Как правило, в названиях препаратов этой группы фигурируют слова «рапид» или «регуляр».
Инсулины продленного действия. Удлинения действия инсулина добиваются путем замедления его всасывания. При этом используют следующие препараты инсулина:
· Суспензию аморфного цинк-инсулина – содержит инсулин с избытком ионизированного цинка, который способствует образованию мелких плохорастворимых кристаллов инсулина.
· Суспензию изофанного инсулина или инсулина-NPH (neutral protamine Hagedorn) – содержит смесь эквимолярных количеств инсулина и оснóвного белка протамина, который образует с инсулином плохорастворимый комплекс.
· Суспензию протамин-цинк инсулина – смесь содержащая инсулин и избыток ионизированного цинка с протамином.
Время развития сахаропонижающего эффекта после приема продленных инсулинов представлено в таблице 7. Как правило, в названиях препаратов этой группы фигурируют слова «тард», «миди», «ленте».
Ранее в виде продленных инсулинов (например, Инсулин-С) использовали также комплекс инсулина и синтетического вещества сурфена (аминохурида). Однако, такие препараты не нашли широкого применения в виду того, что сурфен часто вызывал аллергию и имел кислый рН (его инъекции были достаточно болезненны).
Инсулины длительного действия. Представляют кристаллическую суспензию цинк-инсулина. Длительное время для получения этих препаратов использовали говяжий инсулин, т.к. в его А-цепи содержатся более гидрофобные аминокислоты, чем у инсулина свиньи или человека (аланин и валин) и он несколько хуже растворим. В 1986 г. фирма Novo Nordisk создала продленный инсулин на основе инсулина человека. Следует помнить, что создание препарата длительного действия на основе свиного инсулина в настоящее время невозможно и любую попытку объявить препарат на основе свиного инсулина как препарат длительного действия следует расценивать как фальсификацию. Как правило, в названиях препаратов длительного действия присутствует фрагмент «ультра».
Таблица 7. Характеристика сахаропонижающего эффекта препаратов инсулина.
| Вид инсулина | Эффект после подкожн. введения | Коммерческий препарат | ||
| начало | максимум | длительн. | ||
| Короткие инсулины · Раствор инсулина · Раствор цинк-инсулина | 0,5-1,0 | 2-3 | 6-8 | Actrapid MC (NN) Actrapid HM (NN) Humulin regular (EL) |
| Продленные инсулины · Суспензия аморфного цинк-инсулина · Изофанный инсулин NPH · Суспензия протамин-цинк инсулина | 2-3 | 5-6 6-8 8-10 | 10-16 20-24 20-24 | Brinsulmidi (BPh) Monotard MC (NN) Protaphane HM (NN) Humulin NPH (EL) |
| Инсулины длительного действия · Суспензия цинк-инсулина кристаллического | 4-6 | 8-14 | 25-28 | Ultratard HM (NN) |
| Комбинированные инсулины (растворимый / изофанный) · 20/80 · 30/70 | 0,5-1,0 | 2-3 2-8 | 20-24 | Mixtard 20 HM penfil Humulin M2 Mixtard 30 HM penfil Humulin M3 |
Комбинированные инсулины. Для удобства пациентов, которые пользуются коротким и продленным инсулином выпускают готовые смеси инсулина короткого действия с NPH-инсулином в различных сочетаниях 10/90, 20/80, 30/70, 40/60 и 50/50. Наиболее популярными являются смеси 20/80 (используют лица с ИНСД в фазе инсулинопотребности) и 30/70 (используют пациенты с ИЗСД при режиме 2-кратных инъекций).
Показания к терапии инсулином. Основные показания связаны с назначением инсулина для лечения сахарного диабета:
· Инсулинзависимый сахарный диабет (диабет I типа).
· Лечение гипергликемических ком при диабете (кетоацидотической, гиперосмолярной, гиперлактацидемической) – по этому показанию используют только препараты короткого действия, которые вводят внутривенно или внутримышечно.
· Лечение инсулиннезависимого сахарного диабета в фазу инсулинопотребности (длительно болеющие пациенты с невозможностью контролировать уровень гликемии при помощи диеты и пероральных средств).
· Лечение инсулиннезависимого сахарного диабета у беременных.
· Лечение инсулиннезависимого сахарного диабета во время инфекционных заболеваний, при выполнении хирургических вмешательств.
Иногда инсулин применяют для лечения состояний не связанных с сахарным диабетом: 1) в составе калий-поляризующих смесей (смесь 200 мл 5-10% раствора глюкозы, 40 мл 4% раствора хлорида кальция и 4-6 ЕД инсулина) при лечении аритмий и гипокалиемии; 2) при инсулин-коматозной терапии у больных шизофренией с ярко выраженной негативной симптоматикой.
Принципы дозирования и применения инсулина:
1. Подбор доз инсулина выполняют в стационаре, под контролем уровня гликемии и наблюдением квалифицированного врача.
2. Флаконы инсулина следует хранить в холодильнике, не допуская замерзания раствора. Перед применением инсулин должен быть подогрет до температуры тела. При комнатной температуре флакон с инсулином может храниться только в пенале шприц-ручки.
3. Препараты инсулина следует вводить подкожно, периодически меняя места инъекций. Пациент должен знать, что наиболее медленно инсулин всасывается из подкожной клетчатки бедра, в клетчатке плеча его скорость абсорбции выше в 2 раза, а из клетчатки живота – в 4 раза. Внутривенное введение возможно только для инсулинов короткого действия, т.к. они представляют собой истинные растворы.
4. В одном шприце инсулины короткого действия можно смешивать только с NPH-инсулинами, т.к. эти инсулины не содержат избытка протамина или цинка. Во всех других продленных инсулинах имеется свободный цинк или протамин, который будет связывать инсулин короткого действия и непредсказуемо замедлять его действие. При наборе инсулина в шприц вначале следует набрать инсулин короткого действия и только затем набирать в шприц инсулин длительного действия.
5. Инъекцию инсулина выполняют за 30 мин до приема пищи, чтобы синхронизировать действие инсулина с периодом постпрандиальной гликемии.
6. Первичный выбор дозы инсулина осуществляют исходя из идеальной массы тела и длительности заболевания.
Идеальная масса тела, кг = (рост, см – 100) – 10% - у мужчин;
Идеальная масса тела, кг = (рост, см – 100) – 15% - у женщин;
Таблица 8. Выбор дозы инсулина в зависимости от длительности заболевания.
| Особенность заболевания | Суточная доза ЕД/кг идеальной массы |
| Впервые выявленный диабет Компенсированный диабет в первый год Диабет в течение 2-5 лет Диабет более 5 лет Кетоацидоз или кетоацидотическая кома Диабет у детей до пубертатного возраста | 0,5 0,4 0,5-0,7 0,7-0,9 0,9-1,0 0,2-0,4 |
Если пациент получает в сутки более 0,9 ЕД/кг инсулина это указывает на его передозировку и необходимо понизить дозу инсулина.
7. Введение инсулина проводят таким образом, чтобы имитировать естественный ритм секреции инсулина и гликемический профиль у здорового человека. Используют 2 основные схемы терапии:
· Интенсифицированная схема или базис-болюсное введение. Пациент имитирует базальный уровень секреции инсулина 1-2 инъекциями продленного инсулина (⅓ суточной дозы) и пиковую секрецию инсулина введением короткого инсулина перед каждым приемом пищи (⅔ суточной дозы). Распределение дозы короткого инсулина между завтраком, обедом и ужином проводят в зависимости от количества съеденной пищи из расчета:
1,5-2,0 ЕД инсулина на 1 хлебную единицу (1 ХЕ = 50 ккал) перед завтраком;
0,8-1,2 ЕД инсулина на 1 ХЕ перед обедом;
1,0-1,5 ЕД инсулина на 1 ХЕ перед ужином.
· Режим 2-кратных введений смеси инсулинов короткого и длительного действия. При этом режиме перед завтраком вводят ⅔ суточной дозы инсулина, а перед ужином – оставшуюся ⅓. В каждой дозе ⅔ составляет инсулин продленного действия и ⅓ инсулин короткого действия. Эта схема требует строгого соблюдения времени приема пищи (особенно обеда и промежуточных приемов – 2-го завтрака и полдника), что обусловлено высокой инсулинемией в течение дня из-за высокой дозы продленного инсулина.
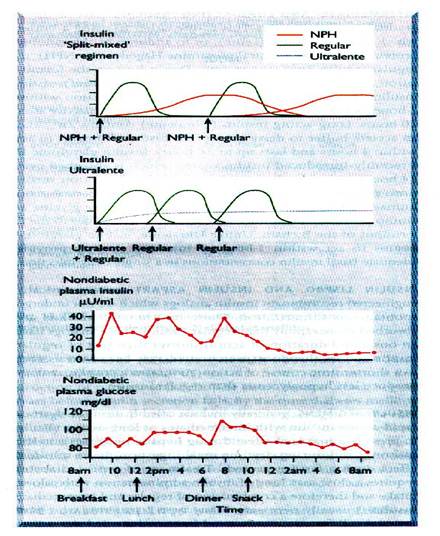
Схема 5. Различные виды инсулинотерапии. На схеме представлены профиль гликемии после приемов пищи в течении суток (внизу) и уровень инсулинемии (второй снизу график) у здорового добровльца. На третьем снизу графике приведена инсулинемия при интенсифицированной терапии (1 инъекция длительного инсулина утром и 3 инъекции короткого инсулина перед едой). Вверху показана инсулинемия при режиме двукратного введения инсулина (2 инъекции комбинации короткого и продленного инсулина).
8. Коррекцию дозы инсулина осуществляют на основании результатов измерения гликемии натощак (перед очередным приемом пищи) и через 2 часа после еды. При этом следует помнить, что изменение дозы инсулина за 1 прием не должно превышать 10%.
· Утренняя гликемия позволяет оценить адекватность вечерней дозы инсулина;
· Гликемия через 2 часа после завтрака – утреннюю дозу короткого инсулина.
· Гликемия перед обедом – утреннюю дозу продленного инсулина.
· Гликемия перед сном – обеденную дозу короткого инсулина.
9. При переводе пациента с ксеногенного инсулина на инсулин человека дозу следует уменьшить на 10%.
НЭ (Осложнения инсулиновой терапии):
1. Аллергические реакции на инсулин. Связаны с присутствием в препаратах инсулина посторонних примесей, обладающих антигенными свойствами. Человеческий инсулин крайне редко вызывает это осложнение. Аллергические реакции проявляются в виде зуда, жжения, сыпи в местах инъекций. В тяжелых случаях возможно развитие отека Квинке, лимфаденопатии (увеличения лимфатических узлов) и анафилактического шока.
2. Липодистрофии – нарушение липогенеза и липолиза в подкожной клетчатке в области инъекций инсулина. Проявляется либо полным исчезновением клетчатки (липоатрофия) в виде углублений на коже или ее разрастанием в виде узлов (липогипертрофии). Для их профилактики рекомендуется периодически менять места инъекций, не пользоваться затупленными иглами и холодным инсулином.
3. Инсулиновые отеки – возникают в начале лечения, связаны с прекращением полиурии и увеличением объема внутриклеточной жидкости (т.к. увеличивается поступление глюкозы в клетку и, следовательно, внутриклеточное осмотическое давление, которое обеспечивает ток воды в клетку). Обычно проходят самостоятельно.
4. Феномен «утренней зари». Гипергликемия в ранние утренние часы (между 5-8 часами утра). Обусловлена циркадианными ритмами секреции контринсулярных гормонов - кортизола и СТГ, которые вызывают повышение уровня глюкозы, а также недостаточной продолжительностью действия продленного инсулина, который пациент вводит перед ужином. Для уменьшения этого эффекта следует перенести на более позднее время вечернюю инъекцию продленного инсулина.
5. Гипогликемические состояния и гипогликемическая кома. Связаны либо с превышением дозы вводимого инсулина, либо с нарушением режима инсулинотерапии (введение инсулина без последующего приема пищи, интенсивные физические нагрузки). Характеризуется появлением чувства голода, потливостью, головокружением, двоением в глазах, онемением губ и языка. Зрачки у пациента резко расширены. В тяжелых случаях возникают судороги мышц с последующим развитием комы. Помощь заключается в приеме внутрь 50,0-100,0 г сахара, растворенного в теплой воде или чае, возможно применение конфет, меда, варенья. Если пациент потерял сознание необходимо ввести внутривенно 20-40 мл 40% раствора глюкозы или втереть в его десны мед (он содержит фруктозу, которая хорошо всасывается через слизистую рта). Желательно ввести один из контринсулярных гормонов – 0,5 мл 0,1% раствора адреналина подкожно или 1-2 мл глюкагона внутримышечно.
6. Инсулинорезистентность (снижение чувствительности тканей к действию инсулина и необходимость увеличения его суточной дозы до 100-200 ЕД). Основной причиной инсулинорезистентности является выработка антител к инсулину и его рецепторам. Чаще всего образование антител вызывают ксеногенные инсулины, поэтому таких пациентов необходимо перевести на человеческие инсулины. Однако, даже инсулин человека может вызвать образование антител. Это связано с тем, что он разрушается инсулиназой подкожной клетчатки с образованием антигенных пепетидов.
7. Синдром Соммоджи (хроническая передозировка инсулина). Применение высоких доз инсулина вызывает вначале гипогликемию, но затем рефлекторно развивается гипергликемия (происходит компенсаторный выброс контринсулярных гормонов – кортизола, адреналина, глюкагона). Одновременно, стимулируется липолиз и кетогенез, развивается кетоацидоз. Синдром проявляется резкими колебаниями уровня глюкозы в крови в течение дня, эпизодами гипогликемии, кетоацидозом и кетонурией без глюкозурии, повышением аппетита и увеличением массы тела несмотря на тяжелое течение диабета. Для устранения этого синдрома необходимо уменьшить дозу инсулина.
ФВ: флаконы и картриджи по 5 и 10 мл с активностью 40 ЕД/мл и 100 ЕД/мл.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 791; Нарушение авторских прав?; Мы поможем в написании вашей работы!