
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация слабых электролитов
Диссоциация сильных электролитов
Сильные электролиты в водных растворах диссоциируют практически полностью:
· кислоты диссоциируют в водных растворах с образованием катионов H+:
HNO3 = H+ + NO3–
· основания диссоциируют, образуя в качестве анионов OH–:
NaOH = Na+ + OH–
Ba(OH)2 = Ba2+ + 2 OH–
· диссоциация средних солей сопровождается образованием катионов металлов или аммония и кислотных остатков:
NaCl = Na+ + Cl–
Fe2(SO4)3 = 2 Fe3+ + 3 SO42–.
Слабые электролиты диссоциируют ступенчато и обратимо, т. е. к процессу диссоциации слабых электролитов применим закон действия масс, константу равновесия в этом случае называют константа диссоциации.
Диссоциация слабых кислот:
H2CO3  H+ + HCO3–
H+ + HCO3–
HCO3–  H+ +CO32–
H+ +CO32–

 .
.
Диссоциация слабых оснований:
Cu(OH)2  CuOH+ + OH–
CuOH+ + OH–
CuOH+  Cu2+ + OH–
Cu2+ + OH–
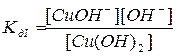
 .
.
Диссоциация амфотерных гидроксидов протекает по основному:
Zn(OH)2  ZnOH+ + OH–
ZnOH+ + OH–
ZnOH+  Zn2+ + OH–
Zn2+ + OH–
и кислотному типу
H2ZnO2  H+ + HZnO2–
H+ + HZnO2–
HZnO2–  H+ + ZnO22–.
H+ + ZnO22–.
Диссоциация кислых и основных солей имеет некоторые особенности. По первой ступени диссоциация этих соединений протекает по правилам сильных электролитов, а далее диссоциация протекает по правилам слабых электролитов (ступенчато и обратимо):
KH2PO4 = K+ + H2PO4–
H2PO4–  H+ + HPO42–
H+ + HPO42–
HPO42–  H+ + PO43–
H+ + PO43–
CuOHCl = CuOH+ + Cl–
CuOH+  Cu2+ + OH–.
Cu2+ + OH–.
|
|
Дата добавления: 2014-10-15; Просмотров: 989; Нарушение авторских прав?; Мы поможем в написании вашей работы!