
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Ван-дер-Ваальса
|
|
|
|
Модель идеального газа, используемая в МКТ, позволяет описывать поведение разреженных реальных газов при низких давлениях и достаточно высоких температурах.
Для описания поведения реальных газов в широком интервале плотностей голландским физиком Ван-дер-Ваальсом в 1873 году было предложено уравнение  , где
, где 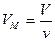 - молярный объем,
- молярный объем,  - давление газа на стенки сосуда,
- давление газа на стенки сосуда,  и
и 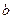 - постоянные Ван-дер-Ваальса (у каждого газа они свои),
- постоянные Ван-дер-Ваальса (у каждого газа они свои),  - универсальная газовая постоянная,
- универсальная газовая постоянная, 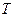 - термодинамическая температура.
- термодинамическая температура.
Это уравнение было получено путем внесения поправок в уравнение Менделеева - Клапейрона 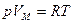 . Поправка
. Поправка  характеризует добавку к внешнему давлению, обусловленную взаимным притяжением молекул друг к другу (т.е. внутреннее давление). Вследствие взаимного притяжения молекул газ как бы сжимается большим давлением, чем давление газа на стенки сосуда (
характеризует добавку к внешнему давлению, обусловленную взаимным притяжением молекул друг к другу (т.е. внутреннее давление). Вследствие взаимного притяжения молекул газ как бы сжимается большим давлением, чем давление газа на стенки сосуда ( - давление, оказываемое на газ извне). Обратная пропорциональность поправки квадрату объема (~
- давление, оказываемое на газ извне). Обратная пропорциональность поправки квадрату объема (~ 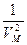 ) обусловлена тем, что вследствие быстрого убывания сил притяжения между молекулами с увеличением расстояния
) обусловлена тем, что вследствие быстрого убывания сил притяжения между молекулами с увеличением расстояния 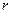 между ними заметное воздействие молекул друг на друга осуществляется только в пределах небольших расстояний, их называют радиусом молекулярного действия.
между ними заметное воздействие молекул друг на друга осуществляется только в пределах небольших расстояний, их называют радиусом молекулярного действия.
Сила притяжения двух малых (элементарных) объемов, имеющих размеры порядка радиуса молекулярного действия пропорциональна числу молекул, заключенных в каждом из этих объемов, т.е.  ~
~ 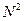 , но число молекул в элементарном объеме пропорционально числу молекул в единице объема газа
, но число молекул в элементарном объеме пропорционально числу молекул в единице объема газа 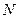 ~
~ 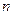 или обратно пропорциональна объему газа
или обратно пропорциональна объему газа 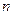 ~
~ 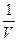 . Таким образом, давление, самосжимающее газ, оказывается прямо пропорционально квадрату концентрации в единице объема (
. Таким образом, давление, самосжимающее газ, оказывается прямо пропорционально квадрату концентрации в единице объема ( ~ n 2 или ~
~ n 2 или ~  ).
).
|
|
|
Поправка 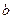 характеризует ту часть объема, которая недоступна для движения молекул. То есть молекулы обладают конечным объемом, поэтому пространство, доступное для движения молекул, оказывается меньшим, чем объем сосуда. Эта поправка равна суммарному объему молекул, содержащихся в моле газа.
характеризует ту часть объема, которая недоступна для движения молекул. То есть молекулы обладают конечным объемом, поэтому пространство, доступное для движения молекул, оказывается меньшим, чем объем сосуда. Эта поправка равна суммарному объему молекул, содержащихся в моле газа.
Если в сосуде содержится 2 молекулы, центр одной не может приблизиться к другой ближе, чем на расстояние, равное диаметру молекулы 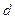 . Это означает, что для центров обеих молекул недоступен сферический объем радиуса
. Это означает, что для центров обеих молекул недоступен сферический объем радиуса 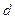 , т.е.
, т.е. 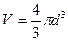 , равный объему восьми молекул, а в расчете на 1 молекулу, - учетверенный объем молекулы (
, равный объему восьми молекул, а в расчете на 1 молекулу, - учетверенный объем молекулы (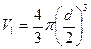 ).
).
Газ, подчиняющийся строго уравнению Ван-дер-ваальса, называют вандерваальсовским газом.
Внутренняя энергия вандерваальсовского газа включает в себя кинетическую энергию молекул и энергию взаимодействия между ними. Для нахождения внутренней энергии вандерваальсовского газа воспользуемся тем, что работа, совершаемая при расширении газа против сил взаимного притяжения молекул друг к другу, равна приращению энергии взаимодействия 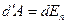 . Силы взаимного притяжения между молекулами учтены в уравнении Ван-дер-ваальса с помощью добавки к давлению
. Силы взаимного притяжения между молекулами учтены в уравнении Ван-дер-ваальса с помощью добавки к давлению  (
( ) – внутреннего давления. Отсюда, работа против сил взаимодействия между молекулами может быть представлена, как
) – внутреннего давления. Отсюда, работа против сил взаимодействия между молекулами может быть представлена, как  (подобно
(подобно  ). Таким образом,
). Таким образом, 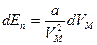 . Проинтегрируем
. Проинтегрируем 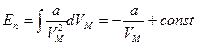 .
.
Внутренняя энергия газа ( ) зависит от объема газа и от температуры, так как
) зависит от объема газа и от температуры, так как  =
=  ,
, 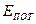 ~
~ 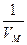 . Отсюда внутреннюю энергию 1 моля газа можно выразить, как
. Отсюда внутреннюю энергию 1 моля газа можно выразить, как  (
( можно включить в
можно включить в  ).
).
Если 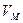 стремится к бесконечности, то данное выражение переходит в
стремится к бесконечности, то данное выражение переходит в 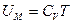 (
( =
=  =1 моль), следовательно,
=1 моль), следовательно,  . Таким образом, внутренняя энергия 1 моля вандерваальсовского газа определяется формулой
. Таким образом, внутренняя энергия 1 моля вандерваальсовского газа определяется формулой 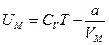 . Если взять v молей, то внутренняя энергия будет определяться как
. Если взять v молей, то внутренняя энергия будет определяться как  .
.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 628; Нарушение авторских прав?; Мы поможем в написании вашей работы!